题目内容
下列依据热化学方程式得出的结论正确的是
| A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ·mol-1 则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 |
| C.已知C(石墨,s)=C(金刚石,s);△H>0,则石墨比金刚石稳定 |
| D.己知2C(s)+2O2(g)=2CO2(g));△H=a、2C(s)+O2(g)=2CO(g);△H=b,则a>b |
C
解析试题分析:A、氢气的燃烧热必须是1mol氢气燃烧生成液态水的过程所放出的热量,液态水变为气态水是吸热的,氢气的燃烧热小于241.8kJ?mol-1,故A错误;B、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=—57.4kJ?mol-1,醋酸是弱酸,存在电离平衡,电离是吸热的,所以含40.0g NaOH的稀溶液与稀醋酸完全中和,放出热量小于57.4kJ,故B错误;C、已知C(s,石墨)═C(s,金刚石)△H>0,反应是吸热反应,则石墨能量小于金刚石,因此石墨比金刚石稳定,故C正确;D、焦炭完全燃烧放出的热量高于不完全燃烧放出的热量,焓变是负值,即a<b,故D错误,答案选C。
考点:考查燃烧热、中和热以及反应热的有关判断和应用

练习册系列答案
相关题目
下列热化学方程式中,正确的是
| A.甲烷的燃烧热△H = -890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═ CO2(g)+2H2O(g)△H = -890.3kJ/mol |
B.一定条件下,将0.5mol N2和1.5m01H2置于密闭容器中充分反应生成NH3放热19.3kJ其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H =-38.6kJ/mol 2NH3(g)△H =-38.6kJ/mol |
| C.在l01lkPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H =-571.6kJ/mol |
| D.HCI和NaOH反应的中和热△H = -57.3kJ/mol,则H2SO4和Ca(OH)2:反应的中和热△H = 2×(-57.3)kJ/mol |
白磷和红磷与氧气反应过程与能量的变化关系如图,E表示能量,则下列说法正确的是( )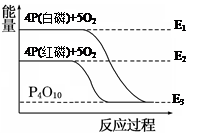
| A.白磷比红磷稳定 |
| B.白磷燃烧是吸热反应 |
| C.红磷转变为白磷是吸热反应 |
| D.红磷燃烧的热化学方程式:4P(s) + 5O2(g)=P4O10(s) ΔH=(E2-E3)kJ/mol |
化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是
| A.化学反应中能量变化的主要原因是化学键的断裂与生成 |
| B.铝热反应中, 反应物的总能量比生成物的总能量低 |
| C.图I所示的装置能将化学能转变为电能 |
| D.图II所示的反应为吸热反应 |
下列化学变化中,反应物的总能量低于生成物的总能量的是( )
A.2H2 +O2 2H2O 2H2O | B.CaO + H2O= Ca(OH)2 |
C.CaCO3 CaO + CO2↑ CaO + CO2↑ | D.CH3CH2OH(酒精)+ 3O2 2CO2 + 3 H2O 2CO2 + 3 H2O |
中和热测定实验中,通过简易量热计直接测得的数据是
| A.反应的热量变化 | B.体系的温度变化 |
| C.酸或碱的浓度变化 | D.生成水的物质的量 |
下列说法正确的是
| A.甲烷的标准燃烧热为-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2O(g)△H=" -890.3" kJ/mol |
B.500℃、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: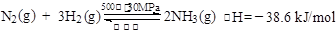 |
C.已知:2CO(g)+O2(g) ===2CO2(g)ΔH=" -566" kJ/mol,下图可表示由CO生成CO2的反应过程和能量关系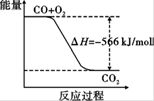 |
| D.已知:1mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F-F 、S-F键需吸收的能量分别为160 kJ、330 kJ。已知1个 SF6(g)分子中含有6条S-F键。则:S(s)+3F2(g) ===SF6(g) △H=-1220 kJ/mol |
已知2H2(g)+O2(g) →2H2O(l)+571.6kJ,2H2(g)+O2(g) →2H2O(g)+483.6kJ。下列说法正确的是
| A.2 molH2(g)和1molO2(g)的总能量小于2mol H2O (l)的能量 |
| B.1 mol H2O (g)分解成H2(g)和O2 (g),吸收241.8kJ能量 |
| C.1mol H2O (l)变成1mo1 H2O (g),吸收88 kJ能量 |
| D.等质量的H2O (g)比H2O(l)所含能量低 |
反应3X(g)+Y(g) 2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率v为( )
2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率v为( )
| A.v(X)=0.05mol·L-1·min-1 | B.v(Z)= 0.10mol·L-1·min-1 |
| C.v(Y)=0.10mol·L-1·min-1 | D.v(W)=0.05mol·L-1·s-1 |