题目内容
【题目】浓硝酸具有强氧化性。
①把铜粉和铁粉混合物加入热的浓硝酸中,充分反应后,溶液中有铜剩余,则溶液中存在的金属阳离子为___。
②某稀硫酸与稀硝酸的混合溶液中,c(SO42-)+c(NO3-)=3.0mol·L-1。取200mL该混合酸,能溶解铜的最大质量为___。
【答案】Fe2+、Cu2+ 23.04g
【解析】
①把铜粉和铁粉混合物加入热的浓硝酸中,铜和铁均与热浓硝酸反应,生成硝酸铜和硝酸铁,若铁过量还会生成硝酸亚铁,据此分析;
②依据物质的量的相关计算分析。
①把铜粉和铁粉混合物加入热的浓硝酸中,铜和铁均与热浓硝酸反应,生成硝酸铜和硝酸铁,若铁过量还会生成硝酸亚铁,则溶液中可能存在的金属阳离子为Fe2+、Fe3+、Cu2+,但溶液中有铜剩余,铜会与Fe3+反应生成Fe2+,则溶液中存在的金属阳离子为Fe2+、Cu2+,
故答案为:Fe2+、Cu2+;
②某稀硫酸与稀硝酸的混合溶液 中,c(SO42-)+c(NO3-)=3.0mol·L-1,取200mL该混合酸,加入铜,反应的离子方程式为:3Cu+2NO3+8H+=3Cu2++2NO↑+4H2O,要使溶解铜的质量最大,则氢离子和硝酸根浓度满足化学计量数4:1,硝酸全部起氧化剂作用,设硫酸浓度为x,则硝酸浓度为:3.0mol/Lx,溶液中氢离子浓度共:2x+(3.0mol/Lx),
则![]() ,
,
解得:x=1.8mol/L,
则硝酸浓度为:3.0mol/Lx=1.2mol/L,硝酸的物质的量为:0.2L×1.2mol/L=0.24mol,
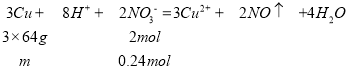
则能溶解铜的最大质量为:![]() ,
,
故答案为:23.04g。

练习册系列答案
相关题目