题目内容
【题目】工厂中用稀硫酸浸泡某矿石后的溶液中,除了含有大量硫酸外,还含有少量![]() 、Fe3+、
、Fe3+、![]() 、Cl。为除去杂质离子,部分操作流程如图:
、Cl。为除去杂质离子,部分操作流程如图:

请回答问题:
(1)用稀硫酸浸泡某矿石后的溶液中,硫酸的密度为4.9gL1,则该溶液中的pH约为 。
(2)![]() 在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在.现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(
在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在.现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(![]() )恰好是NH4Cl溶液中c(
)恰好是NH4Cl溶液中c(![]() )的2倍,则c[(NH4)2SO4]___________c(NH4Cl)(填:<、=或>)。
)的2倍,则c[(NH4)2SO4]___________c(NH4Cl)(填:<、=或>)。
(3)随着向废液中投入生石灰(忽略溶液温度的变化),溶液中![]() (填“增大”“减小”或“不变”)。
(填“增大”“减小”或“不变”)。
(4)投入生石灰调节pH到2~3时,大量沉淀主要成分为CaSO42H2O[含有少量Fe(OH)3],提纯CaSO42H2O的主要操作步骤:向沉淀中加入过量 ,充分反应后,过滤、洗涤、 。
(5)25℃,H3AsO4电离常数为K1=5.6×103,K2=1.7×107,K3=4.0×1012。当溶液中pH调节到8~9时,沉淀主要成分为Ca3(AsO4)2。
①pH调节到8左右Ca3(AsO4)2才开始沉淀的原因是 。
②Na3AsO4第一步水解的平衡常数数值为: 。
③已知:![]() +2I+2H+
+2I+2H+![]()
![]() +I2+H2O,SO2+I2+2H2O
+I2+H2O,SO2+I2+2H2O![]()
![]() +2I+4H+。上述两个反应中还原性最强的微粒是 。
+2I+4H+。上述两个反应中还原性最强的微粒是 。
【答案】(1)1
(2)<
(3)减小
(4)稀硫酸 干燥或晾干
(5)①H3AsO4是弱酸,当溶液中pH调节到8左右,c(![]() )增大,Ca3(AsO4)2开始沉淀 ②2.5×103 ③SO2
)增大,Ca3(AsO4)2开始沉淀 ②2.5×103 ③SO2
【解析】本题考查化学工艺流程,涉及沉淀的溶解平衡、盐的水解、弱电解质的电离和离子方程式的书写等。(1)硫酸的密度为4.9gL1,c(H2SO4) =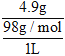 = 0.05 mol/L,则c(H+)=0.1 mol/L,pH=1;
= 0.05 mol/L,则c(H+)=0.1 mol/L,pH=1;
(2)离子浓度越大水解程度越小,如c[(NH4)2SO4]=c(NH4Cl),则(NH4)2SO4溶液中c(![]() )小于 NH4Cl溶液中c(
)小于 NH4Cl溶液中c(![]() )的2倍,等于2倍时,则c[(NH4)2SO4] <c(NH4Cl);
)的2倍,等于2倍时,则c[(NH4)2SO4] <c(NH4Cl);
(3)随着向废液中投入生石灰,c(OH)增大,c(NH3H2O)减小,则溶液中![]() 减小;
减小;
(4)提纯CaSO42H2O,可加入稀硫酸溶解Fe(OH)3,且能防止CaSO42H2O的溶解,过滤后洗涤、干燥,可得纯净的CaSO42H2O;
(5)①H3AsO4是弱酸,电离出来的![]() 较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀,当溶液中pH调节到8左右时
较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀,当溶液中pH调节到8左右时![]() 浓度增大,Ca3(AsO4)2开始沉淀;②Na3AsO4的第一步水解的离子方程式为:
浓度增大,Ca3(AsO4)2开始沉淀;②Na3AsO4的第一步水解的离子方程式为:![]() +H2O
+H2O![]()
![]() +OH,该步水解的平衡常数Kh =
+OH,该步水解的平衡常数Kh =![]() =
=![]() =2.5×103; ③根据还原剂的还原性大于还原产物的还原性,则还原性SO2>I>
=2.5×103; ③根据还原剂的还原性大于还原产物的还原性,则还原性SO2>I>![]() ,两个反应中还原性最强的微粒是SO2。
,两个反应中还原性最强的微粒是SO2。

 阅读快车系列答案
阅读快车系列答案【题目】黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1 g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:
![]()

【实验一】:测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:

①鼓入空气的作用是_________________________________。
②反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)________________________________________。
H2O2可以看作是一种很弱的酸,写出其电离方程式:_____________________。
(3)该黄铁矿石中硫元素的质量分数为______________(列出表达式即可)。
【实验二】:测定铁元素的含量

(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量____________(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______________。


