题目内容
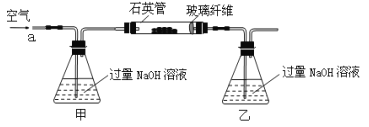
【题目】黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1 g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:
![]()
【实验一】:测定硫元素的含量
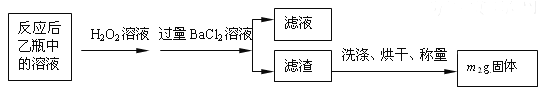
反应结束后,将乙瓶中的溶液进行如下处理:
①鼓入空气的作用是_________________________________。
②反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)________________________________________。
H2O2可以看作是一种很弱的酸,写出其电离方程式:_____________________。
(3)该黄铁矿石中硫元素的质量分数为______________(列出表达式即可)。
【实验二】:测定铁元素的含量
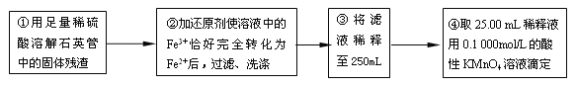
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量____________(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______________。
【答案】 除去空气中的CO2,使乙装置中的溶液只吸收黄铁矿煅烧产生的SO2 使SO32-完全氧化为SO42- H2O2![]() HO2-+H+ 32m2/233m1×100% 偏大 250mL容量瓶 0.5mol/L
HO2-+H+ 32m2/233m1×100% 偏大 250mL容量瓶 0.5mol/L
【解析】(1)空气中含有二氧化碳,能和乙中的氢氧化钠反应生成碳酸钠,碳酸钠和氯化钡反应生成碳酸钡导致沉淀量增大,从而导致干扰硫元素的测定,所以要把空气中二氧化碳除去,用氢氧化钠或氢氧化钾溶液除去即可,所以甲中盛放的是氢氧化钠溶液或氢氧化钾溶液;乙中二氧化硫和氢氧化钠反应生成亚硫酸钠,离子方程式为 SO2+2OH-=SO32-+H2O;(2)为使亚硫酸根离子完全转化为硫酸根离子,加入的双氧水要足量;(3)双氧水的电离方程式为H2O2![]() HO2-+H+;(4)最终所得沉淀是硫酸钡,根据硫原子守恒得硫的质量,设硫的质量为x,
HO2-+H+;(4)最终所得沉淀是硫酸钡,根据硫原子守恒得硫的质量,设硫的质量为x,
S~~BaSO4
32g 233g
x m2g
x=32m2/233g,质量分数=32m2/233m1×100%;
(5)铁和铁离子反应生成的亚铁离子物质的量增大,用高锰酸钾物质的量增大,测定结果偏大;(6)步骤③中,一定物质的量浓度溶液的配制中,除了烧杯、玻璃棒、胶头滴管外,还需要250mL容量瓶;(6)根据表中数据可知第三次实验误差大,舍去。滴定过程中高锰酸钾溶液平均消耗体积=(25+25.03+24.97)mL/3=25mL;根据方程式5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O可知,设亚铁离子物质的量为x,则
X=0.1mol/L×0.025L×5=0.0125mol;c(Fe2+)=0.0125mol÷0.025L=0.5mol/L。