题目内容
14.下列关于pH变化的判断正确的是( )| A. | 温度升高,Na2CO3溶液pH减小 | |
| B. | 氢氧化钠溶液久置于空气中,溶液pH变大 | |
| C. | 新制氯水经光照一段时间后,溶液pH减小 | |
| D. | 温度升高,纯水pH增大 |
分析 A、碳酸钠溶液中碳酸根离子的水解是吸热反应;
B、氢氧化钠会吸收空气中的二氧化碳生成碳酸钠,氢氧根离子浓度减小;
C、新制氯水中含有氯气和水反应生成的次氯酸,次氯酸见光分解,最后得盐酸,溶液酸性增强;
D、水的电离是吸热过程,升温平衡正向进行,氢离子、氢氧根离子浓度增大.
解答 解:A、碳酸钠溶液中碳酸根离子的水解是吸热反应,升温促进水解正向进行,溶液减小增强,pH增大,故A错误;
B、氢氧化钠会吸收空气中的二氧化碳生成碳酸钠,氢氧根离子浓度减小,溶液pH减小,故B错误;
C、新制氯水中含有氯气和水反应生成的次氯酸,次氯酸见光分解,最后得稀盐酸,溶液酸性增强,pH减小,故C正确;
D、水的电离是吸热过程,升温平衡正向进行,氢离子、氢氧根离子浓度增大,所以纯水pH减小,故D错误;
故选C.
点评 本题考查了弱电解质电离、盐类水解原理的分析应用,注意水解和弱电解质电离都是吸热过程,升温促进,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列物质中既能与盐酸反应又能与NaOH溶液反应,且都不产生气体的是( )
| A. | NH4HCO3 | B. | Na2SiO3 | C. | Na2CO3 | D. | Al2O3 |
19.下列溶液一定呈中性的是( )
| A. | 室温时将pH=5的盐酸稀释100倍所得到的溶液 | |
| B. | 等物质的量的强酸和强碱反应后所得到的混合溶液 | |
| C. | 氢氧化钠溶液与醋酸溶液混合后c(Na+)=c(CH3COO-)的溶液 | |
| D. | 硝酸铵溶于水得到的溶液 |
6.下列反应的离子方程式正确的是( )
| A. | 过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑ | |
| B. | 铜丝在氯气中燃烧:Cu+Cl2$\frac{\underline{\;点燃\;}}{\;}$Cu2++2Cl- | |
| C. | 氢氧化镁溶于盐酸:Mg(OH)2+2H+=Mg2++2H2O | |
| D. | 氯化铁溶液腐蚀铜箔制印刷线路板:Fe3++Cu=Fe2++Cu2+ |
4.下列关于材料的说法正确的是( )
| A. | 水泥是常见的硅酸盐产品 | B. | 光导纤维的主要成分是二氧化硅 | ||
| C. | 蚕丝的主要成分是纤维素 | D. | 合金中一定只含金属元素 |
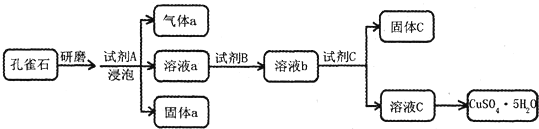
 利用硫酸铜晶体制取氧化铜,然后利用制取的氧化铜作催化剂来使氯酸钾分解制取氧气的.回答下列问题:
利用硫酸铜晶体制取氧化铜,然后利用制取的氧化铜作催化剂来使氯酸钾分解制取氧气的.回答下列问题: