题目内容
【题目】在容积为2L的密闭容器中发生反应xA(g)+yB(g)zC(g)。图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示温度100℃和200℃平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
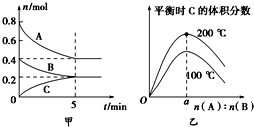
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04molL-1min-1
B.200℃时,该反应的平衡常数为25L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g)zC(g)的△H<0,且a=2
【答案】B
【解析】
A、图象分析可知A物质的量变化0.8mol-0.4mol=0.4mol,B物质的量变化=0.4mol-0.2mol=0.2mol,反应速率v=![]() ;
;
B、平衡常数K=![]() ;
;
C、降低温度反应速率减小;
D、图象分析可知温度升高平衡时C的体积分数增大,说明升温平衡正向进行,正反应为吸热反应。
A、图象分析可知A物质的量变化0.8mol-0.4mol=0.4mol,B物质的量变化=0.4mol-0.2mol=0.2mol,反应从开始到平衡的平均速率v(A)>v(B),故A错误;
B、200℃时,图象可知,反应的A物质的量0.8mol-0.4mol=0.4mol,B物质的量变化=0.4mol-0.2mol=0.2mol,C的物质的量变化为0.2mol,物质的量之比等于化学方程式计量数之比,化学方程式:2A+BC,平衡状态下ABC物质的量分别为0.4mol、0.2mol,0.2mol,该反应的平衡常数=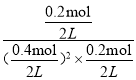 =25L2/mol2,故B正确;
=25L2/mol2,故B正确;
C、当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均减小,故C错误;
D、图象分析可知温度升高平衡时C的体积分数增大,说明升温平衡正向进行,正反应为吸热反应,△H>0,B计算得到a=2,故D错误。
答案选B。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案