题目内容
【题目】下表是元素周期表的一部分,请用元素符号或化学式回答有关问题:
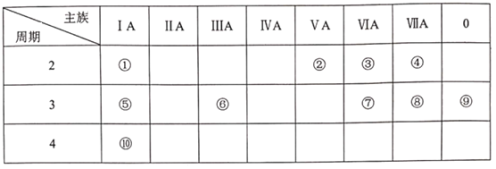
(1)⑧的单质是有毒气体, 它能与强碱稀溶液反应,其离子方程式为_________,③和⑤构成的具有漂白性的化合物,其电子式为______________。
(2)表中能形成两性氧化物的元素是____, 写出该元素的单质与⑩的最高价氧化物的水化物反应的离子方程式__________。
(3)④⑤⑦⑩四种元素简单离子半径由大到小的顺序是_____________。
(4)上述元素的最高价氧化物对应的水化物酸性最强的是______(填写化学式), 非金属气态氢化物还原性最强的是_______(填写化学式)。
【答案】Cl2 + 2OH = Cl + ClO + H2O ![]() Al 2Al + 2OH + 2H2O = 2AlO
Al 2Al + 2OH + 2H2O = 2AlO![]() + 3H2↑ S2 > K+ > F > Na+ HClO4 H2S
+ 3H2↑ S2 > K+ > F > Na+ HClO4 H2S
【解析】
根据元素在周期表中的位置可知,①为Li元素,②为N元素,③为O元素,④为F元素,⑤为Na元素,⑥为Al元素,⑦为S元素,⑧为Cl元素,⑨为Ar元素,⑩为K元素,结合元素周期律和物质的性质分析解答。
(1)⑧为Cl元素,氯气是有毒气体, 它能与强碱稀溶液反应生成两种盐,反应的离子方程式为Cl2 + 2OH = Cl + ClO + H2O,③为O元素,⑤为Na元素,二者构成的具有漂白性的化合物为过氧化钠,其电子式为![]() ,故答案为:Cl2 + 2OH = Cl + ClO + H2O;
,故答案为:Cl2 + 2OH = Cl + ClO + H2O;![]() ;
;
(2)上述十种元素中能形成两性氧化物的元素是Al, ⑩为K元素,⑩的最高价氧化物的水化物为KOH,铝与氢氧化钾反应的离子方程式为2Al + 2OH + 2H2O = 2AlO![]() + 3H2↑,故答案为:Al;2Al + 2OH + 2H2O = 2AlO
+ 3H2↑,故答案为:Al;2Al + 2OH + 2H2O = 2AlO![]() + 3H2↑;
+ 3H2↑;
(3)④为F元素,⑤为Na元素,⑦为S元素,⑩为K元素,一般而言,电子层数越多,半径越大,电子层数相同,原子序数越大,半径越小,四种元素简单离子半径由大到小的顺序是S2 >K+ > F >Na+,故答案为:S2 > K+ > F > Na+;
(4)元素的非金属性越强,最高价含氧酸的酸性越强,上述元素中非金属性最强的是F,但F没有最高价含氧酸,因此最高价氧化物对应的水化物酸性最强的是HClO4,非元素的非金属性越弱,气态氢化物还原性越强,上述元素中非金属性最弱的是S,因此非金属气态氢化物还原性最强的是H2S,故答案为:HClO4;H2S。