题目内容
【题目】现有等体积的硫酸、盐酸和醋酸三种溶液,将它们分别与V1L、V2L、V3L等浓度的NaOH溶液混合,下列说法中正确的是( )
A.若混合前三溶液物质的量浓度相等,混合后溶液呈中性,则V1<V2<V3
B.若混合前三溶液pH相等,酸碱恰好完全反应,则V1=V2>V3
C.若混合前三溶液物质的量浓度相等,酸碱恰好完全反应,则V1>V2>V3
D.若混合前三溶液pH相等,将它们同等倍数稀释后再与足量锌片反应,则醋酸溶液放出气体最多
【答案】D
【解析】
A.若三种溶液浓度相等,体积相等, 硫酸中![]() 最大,醋酸是弱电解质,盐酸是强电解质,所以反应后溶液呈中性时,需要NaOH溶液体积V1>V2>V3,故A错误;
最大,醋酸是弱电解质,盐酸是强电解质,所以反应后溶液呈中性时,需要NaOH溶液体积V1>V2>V3,故A错误;
B.若混合前三种溶液的pH相等,则醋酸浓度大于盐酸,盐酸中氢离子浓度和硫酸中氢离子浓度相等,恰好中和时,需要氢氧化钠溶液的体积V1=V2<V3,故B错误;
C.若混合前三种溶液物质的量浓度相等,等体积时,酸碱恰好完全中和时硫酸中![]() 最大,所以硫酸需要的NaOH溶液体积最多,盐酸和醋酸的物质的量相等,需要的NaOH溶液体积相等,所以其体积大小顺序是V1>V2=V3,故C错误;
最大,所以硫酸需要的NaOH溶液体积最多,盐酸和醋酸的物质的量相等,需要的NaOH溶液体积相等,所以其体积大小顺序是V1>V2=V3,故C错误;
D.若混合前三种溶液的pH相等,醋酸是弱电解质,盐酸、硫酸是强电解质,稀释相同的倍数,促进醋酸电离,所以溶液醋酸中氢离子浓度最大,但盐酸、硫酸中氢离子浓度相等,与足量锌片反应,醋酸放出的气体最多,故D正确;
答案选D。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
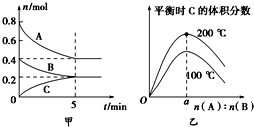
初中暑期衔接系列答案【题目】在3个初始温度均为T℃的密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g) (正反应放热)。下列说法正确的是( )
2SO3(g) (正反应放热)。下列说法正确的是( )
容器编号 | 容器类型 | 初始体积 | 起始物质的量/mol | 平衡时SO3物质的量/mol | ||
SO2 | O2 | SO3 | ||||
I | 恒温恒容 | 1.0 L | 2 | 1 | 0 | 1.6 |
II | 绝热恒容 | 1.0 L | 2 | 1 | 0 | a |
III | 恒温恒压 | 0.5 L | 0 | 0 | 1 | b |
A.a>1.6
B.b<0.8
C.平衡时v正(SO2):v(I)<v(II)
D.若起始时向容器I中充入1.0 mol SO2(g)、0.20 mol O2(g)和4.0 mol SO3(g),则反应将向正反应方向进行