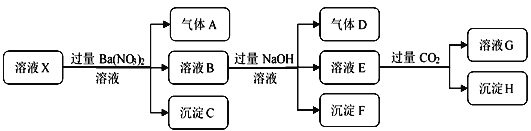
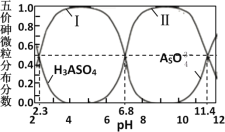
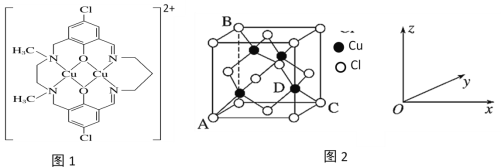
题目内容
【题目】设NA表示阿伏加德罗常数的值,下列叙述中不正确的是
A.常温常压下,71g Cl2含有的氯原子数为2NA
B.1mol Na2O2与H2O完全反应,转移电子数为NA
C.在标准状况下,1L H2O所含分子数为![]()
D.1L 0.5mol/L AlCl3溶液中,含有的Cl–数为1.5NA
【答案】C
【解析】
A、常温常压下,71g Cl2物质的量![]() ,含有的氯原子物质的量为1mol×2 =2mol,含有的氯原子数为2NA,A正确;
,含有的氯原子物质的量为1mol×2 =2mol,含有的氯原子数为2NA,A正确;
B、1mol Na2O2中有2mol氧原子,1mol氧原子升高,1mol氧原子降低,转移1mol电子,因此1mol Na2O2完全反应,转移电子数为NA,B正确;
C、在标准状况下,H2O为液体,不能进行计算,C错误;
D、1L 0.5mol/L AlCl3溶液物质的量![]() ,含有的Cl–物质的量0.5mol×3=1.5mol,含有的Cl–数为1.5NA,D正确;
,含有的Cl–物质的量0.5mol×3=1.5mol,含有的Cl–数为1.5NA,D正确;
综上所述,答案为C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】有甲、乙、丙三个体积均为2L的恒容密闭容器,按不同投料比Z[![]() 进行反应: 4HCl(g)+O2(g)
进行反应: 4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
容器 | 起始时 | 平衡时HCl转化率 | |||
n(HCl)/mol | Z | T=100℃ | T=200℃ | T=300℃ | |
甲 | 0.8 | a | 96% | 94% | 90% |
乙 | 0.8 | b | 46% | 44% | 40% |
丙 | 0.8 | 4 | 95% | 88% | 80% |
下列说法正确的是
A.b<4
B.温度升高时,反应速率减慢,所以转化率下降
C.丙容器中,300℃平衡时,c(O2)=0.04molL-1
D.若甲容器温度在300时需要5min达到平衡,则此时间内v(Cl2)=0.036molL-1min-1