题目内容
8.下列实验能成功的是( )| A. | 苯与浓溴水反应(Fe作催化剂)制溴苯 | |
| B. | 乙醇、冰醋酸、稀硫酸共热制乙酸乙酯 | |
| C. | 氯乙烯加聚后的生成物使酸性KMnO4溶液褪色 | |
| D. | 甲酸甲酯能使新制Cu(OH)2在加热条件下产生红色沉淀 |
分析 A、苯与溴水不反应;
B、酯化反应需要浓硫酸作催化剂;
C、聚氯乙烯中不含有碳碳双键;
D、甲酸甲酯中含有醛基,据此解答即可.
解答 解:A、苯不与溴水反应,故A错误;
B、乙酸乙酯的制取需要浓硫酸,不是稀硫酸,故B错误;
C、聚氯乙烯中不含有碳碳双键,不能使酸性高锰酸钾溶液褪色,故C错误;
D、甲酸甲酯中含有醛基-CHO,能与新制氢氧化铜反应生成氧化亚铜砖红色沉淀,故D正确,故选D.
点评 本题主要考查的是常见有机化合物的性质,注意聚氯乙烯中不含有碳碳双键,难度不大.

练习册系列答案
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
18.下列叙述正确的是( )
| A. | 棉花和蚕丝的主要成分都是纤维素 | |
| B. | 植物油属于油脂,它是一种高分子化合物 | |
| C. | 蔗糖在稀硫酸的催化下,最终全部水解为葡萄糖 | |
| D. | 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯 |
19.在金刚石的晶体中,含有由共价键形成的碳原子环,其中最小的环上所需碳原子数及每个碳原子上任意两个C--C键间的夹角是( )
| A. | 6个120° | B. | 5个108° | C. | 4个109°28′ | D. | 6个109°28′ |
3. 常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)冰比硫化氢热稳定性高的原因是O-H键的键长小于H-S键的键长,硫化氢的分子空间构型为V形;
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表所示:
则X、Y、Z的电负性从大到小的顺序为Al、Mg、Na(用元素符号表示),元素Y第一电离能大于X的原因是因为元素Mg价电子排布式为3s2完全充满状态,比Al稳定;
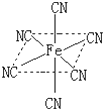
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐,配离子结构如图.
①写出铁元素基态原子价电子排布式3d64s2;
②已知CN-与 N2结构相似,1molCN-中π键数目为2NA;
③写出沉淀溶解的化学方程式Fe(CN)2+4KCN=K4[Fe(CN)6].
 常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)冰比硫化氢热稳定性高的原因是O-H键的键长小于H-S键的键长,硫化氢的分子空间构型为V形;
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐,配离子结构如图.
①写出铁元素基态原子价电子排布式3d64s2;
②已知CN-与 N2结构相似,1molCN-中π键数目为2NA;
③写出沉淀溶解的化学方程式Fe(CN)2+4KCN=K4[Fe(CN)6].
20.下列说法正确的是( )
| A. | 聚乙烯能使溴水褪色 | |
| B. | 油脂是天然高分子化合物 | |
| C. | 葡萄糖分子结构中只有一个醛基,所以是单糖 | |
| D. | 生成高分子化合物的常见反应是加聚反应和缩聚反应 |
17.毛巾、口罩要经常用开水蒸煮消毒,其原理是( )
| A. | 使糖水解 | B. | 使油脂水解 | C. | 使氨基酸变性 | D. | 使蛋白质变性 |
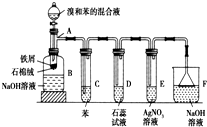 (1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.
(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.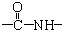 、一个
、一个 、一个
、一个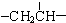 ,还有一个显碱性、一个显酸性的官能团.将该物质在一定条件下水解,能得到两种α-取代羧酸.其中一种的结构简式为:
,还有一个显碱性、一个显酸性的官能团.将该物质在一定条件下水解,能得到两种α-取代羧酸.其中一种的结构简式为: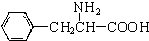 ,另一种水解产物结构简式为:CH3CH(NH2)COOH;
,另一种水解产物结构简式为:CH3CH(NH2)COOH;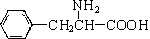 与CH3OH在一定条件下生成的酯是一种有用的合成中间体,利用该酯可与一种醇X发生取代反应,生成一种新的酯(
与CH3OH在一定条件下生成的酯是一种有用的合成中间体,利用该酯可与一种醇X发生取代反应,生成一种新的酯(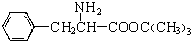 )和CH3OH,则醇X的结构简式为(CH3)3COH.
)和CH3OH,则醇X的结构简式为(CH3)3COH.