题目内容
【题目】按要求回答下列问题:
(1)写出下列各有机物的结构简式
①2-甲基-1-戊烯:_______________________;
②支链只有一个乙基且式量最小的烷烃____________
③若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为______________
(2)结合有机物结构特点对下列问题做出判断:
①新合成的物质A的相对分子质量不超过100,其中C、H的质量分数分别为:w(C)=69.76%,w(H)=11.63%,且完全燃烧后产物只有CO2和H2O。则A的摩尔质量为_________。有关对物质A结构的预测,不正确的是 _______(填序号)。
A.可能含有一个碳碳双键和一个羟基 B.可能含有一个碳环和一个醛基
C.可能只含一个碳氧双键官能团 D.可能是环状的醚
②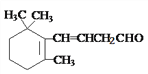 与H2以1:1发生加成反应可得到_____种不同结构的产物。
与H2以1:1发生加成反应可得到_____种不同结构的产物。
【答案】 CH2=C(CH3)CH2CH2CH3 ![]() CH3C≡CCH3 86g/mol B 4
CH3C≡CCH3 86g/mol B 4
【解析】(1)①2-甲基-1-戊烯的结构简式为CH2=C(CH3)CH2CH2CH3;②支链只有一个乙基,说明至少含有7个碳原子,则式量最小的烷烃是![]() ;③若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃是炔烃,结构简式为CH3C≡CCH3;(2)A分子中w(C)=69.76%,w(H)=11.63%,则O的质量分数为1-69.76%-11.63%=18.61%,相对分子质量不超过100,则O原子最大数目=100×18.61%/16=1.2,故含1个O原子,则A的相对分子质量=16/18.61%=86,故A的摩尔质量为86g/mol;有机物分子中C原子数目为86×69.76%/12
;③若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃是炔烃,结构简式为CH3C≡CCH3;(2)A分子中w(C)=69.76%,w(H)=11.63%,则O的质量分数为1-69.76%-11.63%=18.61%,相对分子质量不超过100,则O原子最大数目=100×18.61%/16=1.2,故含1个O原子,则A的相对分子质量=16/18.61%=86,故A的摩尔质量为86g/mol;有机物分子中C原子数目为86×69.76%/12
=5,H原子数目为(8612×516)/1=10,故有机物分子式为C5H10O,不饱和度为(5×2+210)/2=1,可能含有一个碳碳双键和一个羟基,可能只含一个碳氧双键官能团,也可能是环状的醚,不可能含有一个碳环和一个醛基,答案选B;②该有机物分子中含有1,3-丁二烯的结构,1,2-加成有2种,1,4-加成有1种,另外还含有1个醛基,所以与H2以1:1发生加成反应可得到4种不同结构的产物。

 阅读快车系列答案
阅读快车系列答案【题目】某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量。制备流程示意图如下:

已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1 mol·L-1计算)如下表所示:
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀pH | 1.5 | 4.3 | 6.9 |
完全沉淀pH | 2.8 | 5.6 | 8.9 |
②Ni(OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
回答下列问题:
(1)实验需要配制3.0mol·L-1稀硝酸250mL,需要的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和_________________。
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为________________。
(3)步骤(b)首先加入试 剂X调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀。
①调节pH约为6的原因是_______________________________________________。
②试剂X可以是__________________(填标号)。
A. H2SO4 B. Ni(OH)2 C. NaOH D. Fe2O3 E. NiO
(4)NH3含量的测定
i. 用电子天平称量mg产品于锥形瓶中,用25mL水溶解后加入3.00mL 6 mol/L盐酸,以甲基橙作指示剂,滴定至终点消耗0.500 0 mol·L-1NaOH标准溶液V1mL;
ii. 空白试验:不加入样品重复实验i,消耗NaOH标准溶液V2mL。
NH3的质量分数为____________。(用V1 ,V2表示)
②在上述方案的基础上,下列措施能进一步提高测定准确度的有____________(填标号)。
A. 适当提高称量产品的质量 B. 用H2SO4溶液替代盐酸
C. 用酚酞替代甲基橙 D. 进行平行实验
(5)为测定Cl-的含量,请补充完整下述实验方案。
称量mg产品于锥形瓶中,用25mL水溶解,________________,滴入2~3滴K2CrO4溶液作指示剂,用已知浓度的AgNO3标准溶液滴定至终点,记录读数,重复操作2~3次。
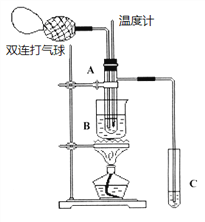
【题目】乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验,并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)____________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A中的位置,在实验开始时,为控制并测量反应溶液的温度,温度计水银球的位置应在_____________;当试管A中的主要反应完成后,为在C中收集乙酸,温度计水银球的位置应在______________,该操作名称为 _____________;烧杯B内盛装的液体可以是____________(写出一种即可,在题给物质中找);
(3)乙酸是非常重要的工业原料,其氯代物——氯乙酸可在工业上生产食品香精菠萝酯(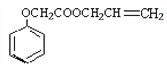 ),实验室模拟工业简易流程如下:
),实验室模拟工业简易流程如下:
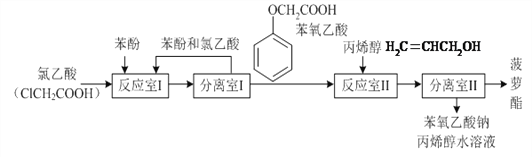
反应室I中发生反应的反应类型是___________。
分离室II的操作为:①用NaHCO3溶液洗涤后分液;②有机层用水洗涤后分液;
洗涤时不能用NaOH溶液代替NaHCO3溶液,其原因是__________________________(用化学方程式表示)。
【题目】下物质分类组合正确的是 ( )
A | B | C | D | |
强电解质 | HCl | FeCl3 | H3PO4 | HClO |
弱电解质 | HF | CH3COOH | NH3·H2O | Ba(OH)2 |
非电解质 | C2H5OH | Zn | H2O | SO3 |
A. A B. B C. C D. D