题目内容
7.根据元素在元素周期表中位置可预测其原子结构,而物质的组成和结构亦可决定物质的性质.(1)用元素符号表示下列微粒
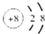
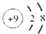
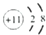

O2-F-Na+Mg
(2)依据原子结构与元素周期律知识,下列排序正确的是ABCD(填字母序号).
A.微粒半径:r(Al3+)<r(Mg2+)<r(Na+)<r(F)<r(O2)
B.物质酸性:H3AlO3<H4SiO4<H3PO4<H2SO4<HClO4
C.熔点高低:Li>Na>K>Rb>Cs
D.与氢气化合容易程度:F2>Cl2>Br2>I2>N2
(3)有X、Y、Z、W四种元素,已知Y和X形成的化合物YX中,X的化合价为-1,Y和Z形成化合物Y2Z,X、Y、Z离子的核外电子总数都是18,W的+1价离子就是质子.
①分别写出下列物质的电子式:YX
 ;W2Z
;W2Z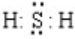 .
.②写出X单质与Y的最高价氧化物对应的水化物常温下反应的化学方程式:Cl2+2KOH=KCl+KClO+H2O.
分析 (1)根据质子数和核外电子数判断;
(2)A.电子层结构相同,核电荷数越大,离子半径越小;电子层数越大,半径越大;
B.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强
C.金属单质的原子半径越小,金属键越强,熔点越高;
D.元素的非金属性越强,单质的氧化性越强,则与氢气化合越容易.
(3)有X、Y、Z、W四种元素,已知Y和X形成的化合物YX中,X的化合价为-1价,则Y为+1价,Y和Z可以形成化合物Y2Z,故Z为-2价,X、Y、Z离子的核外电子数目均为18,则X为Cl元素、Y为K元素,Z为S元素,W的+1价离子就是质子,则W为H元素,据此解答.
解答 解:(1)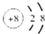 该微粒含有8个质子和10个电子,为O2-;
该微粒含有8个质子和10个电子,为O2-;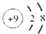 该微粒含有9个质子和10个电子,为F-;
该微粒含有9个质子和10个电子,为F-;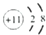 该微粒含有11个质子和10个电子,为Na+;
该微粒含有11个质子和10个电子,为Na+; 该微粒含有12个质子和12个电子,为Mg;
该微粒含有12个质子和12个电子,为Mg;
故答案为:O2-;F-;Na+;Mg;
(2)A.电子层结构相同,核电荷数越大,离子半径越小;电子层数越大,半径越大,则微粒半径:r(Al3+)<r(Mg2+)<r(Na+)<r(F-)<r(O2-),故A正确;
B.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性:Al<Si<P<S<Cl,则物质酸性:H3AlO3<H4SiO4<H3PO4<H2SO4<HClO4,故B正确;
C.金属单质的原子半径越小,金属键越强,熔点越高,则熔点高低:Li>Na>K>Rb>Cs,故C正确;
D.元素的非金属性越强,单质的氧化性越强,则与氢气化合越容易,单质的氧化性:F2>Cl2>Br2>I2,则与氢气化合容易程度:F2>Cl2>Br2>I2,由于N2
中含有N≡N,分子很稳定,所以氮气很难与氢气化合,所以与氢气化合容易程度:F2>Cl2>Br2>I2>N2,故D正确;
故答案为:ABCD;
(3)有X、Y、Z、W四种元素,已知Y和X形成的化合物YX中,X的化合价为-1价,则Y为+1价,Y和Z可以形成化合物Y2Z,故Z为-2价,X、Y、Z离子的核外电子数目均为18,则X为Cl元素、Y为K元素,Z为S元素,W的+1价离子就是质子,则W为H元素,
①KCl存在钾离子和氯离子,钾离子为简单阳离子,氯离子最外层为8电子,氯化钾的电子式为 ;H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,电子式为:
;H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,电子式为: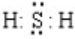 ;
;
故答案为: ;
;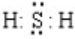 ;
;
.
②Cl2与KOH反应生成KCl和KClO、水,其反应方程式为:Cl2+2KOH=KCl+KClO+H2O;
故答案为:Cl2+2KOH=KCl+KClO+H2O.
点评 本题考查了原子结构示意图、同周期、同主族元素的性质变化规律及元素非金属性的比较方法、元素推断,题目难度中等,侧重于考查学生对基础知识的综合应用能力.

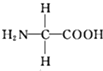
| A. | CH3CHO | B. | H2CO3 | C. | CH3COOH | D. | H2C2O4 |
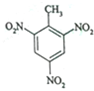 TNT是一种烈性炸药,其结构简式如图所示,它是甲苯与浓硫酸、浓硝酸在一定条件下反应生成的.下列有关TNT的说法正确的是( )
TNT是一种烈性炸药,其结构简式如图所示,它是甲苯与浓硫酸、浓硝酸在一定条件下反应生成的.下列有关TNT的说法正确的是( )| A. | TNT分子式为C7H3O6N3 | |
| B. | TNT的名称叫2,4,6-三硝基甲苯 | |
| C. | 每个TNT分子中可共平面的碳原子最多为6个 | |
| D. | 若硝酸的结构可表示为HO-NO2,每摩尔甲苯可取代3mol硝基制得TNT |
| 有机物 | 无机反应物 | 反应条件 | 反应类型 | 生成物 |
| 乙烯 | Br2 | |||
| 苯 | Br2 | |||
| 苯 | HNO3 |
| A. | 苯酚显弱酸性,它能与氢氧化钠溶液反应 | |
| B. | 在苯酚钠溶液中通入二氧化碳气体,可得到苯酚 | |
| C. | 除去苯中混有的少量苯酚,可用溴水作试剂 | |
| D. | 苯酚有毒,但药皂中掺有少量苯酚 |
 B.
B.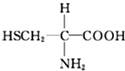
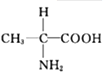 D.
D.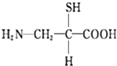
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
 ;
;