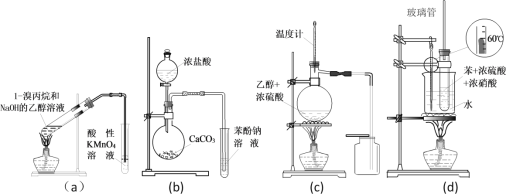
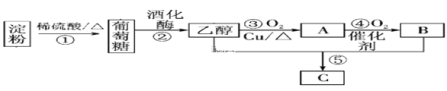
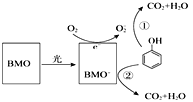
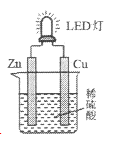
题目内容
【题目】化学与生活、生产密切相关,对下列现象或事实解释错误的是( )
选项 | 现象或事实 | 解释 |
A | 《淮南万毕术》中“曾青得铁则化为铜”是现代湿法冶金的基础 | 该变化是置换反应 |
B | 维生素C将食物中不易吸收的Fe3+转化为Fe2+ | 维生素C具有氧化性 |
C | 高铁酸钠(Na2FeO4)是新型消毒剂,3ClO﹣+2Fe3++10OH﹣═2 | 碱性条件下次氯酸钠的氧化性强于高铁酸钠 |
D | 熔融烧碱时,不能用石英坩埚或陶瓷坩埚 | 烧碱可以与二氧化硅发生反应 |
A.AB.BC.CD.D
【答案】B
【解析】
A.“曾青得铁则化为铜”,发生的反应为Fe+CuSO4=FeSO4+Cu,属于置换反应,A正确;
B.维生素C将Fe3+转化为Fe2+,发生还原反应,维生素C表现出还原性,B错误;
C.在反应3ClO﹣+2Fe3++10OH﹣═2![]() +3Cl﹣+5H2O中,ClO﹣是氧化剂,
+3Cl﹣+5H2O中,ClO﹣是氧化剂,![]() 是氧化产物,氧化性:ClO﹣>
是氧化产物,氧化性:ClO﹣>![]() ,C正确;
,C正确;
D. 石英坩埚和陶瓷坩埚中都含有二氧化硅,熔融烧碱时,发生反应SiO2+2NaOH![]() Na2SiO3+H2O,会损坏坩埚,D正确;
Na2SiO3+H2O,会损坏坩埚,D正确;
故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】实验小组同学对乙醛与新制的Cu(OH)2反应的实验进行探究。
实验Ⅰ:取2mL 10%的氢氧化钠溶液于试管中,加入5滴2%的CuSO4溶液和5滴5%的乙醛溶液,加热时蓝色悬浊液变黑,静置后未发现红色沉淀。
实验小组对影响实验Ⅰ成败的因素进行探究:
(1)探究乙醛溶液浓度对该反应的影响。
编号 | 实验Ⅱ | 实验Ⅲ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变红棕色,静置后底部有大量红色沉淀 | 加热,蓝色悬浊液变红棕色,静置后上层为棕黄色油状液体,底部有少量红色沉淀 |
已知:乙醛在碱性条件下发生缩合反应:CH3CHO+CH3CHO![]() CH3CH=CHCHO+H2O ,生成亮黄色物质,加热条件下进一步缩合成棕黄色的油状物质。
CH3CH=CHCHO+H2O ,生成亮黄色物质,加热条件下进一步缩合成棕黄色的油状物质。
① 能证明乙醛被新制的Cu(OH)2 氧化的实验现象是______。
② 乙醛与新制的Cu(OH)2 发生反应的化学方程式是______。
③ 分析实验Ⅲ产生的红色沉淀少于实验Ⅱ的可能原因:______。
(2)探究NaOH溶液浓度对该反应的影响。
编号 | 实验Ⅳ | 实验Ⅴ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变黑 | 加热,蓝色悬浊液变红棕色, 静置后底部有红色沉淀 |
依据实验Ⅰ→Ⅴ,得出如下结论:
ⅰ. NaOH溶液浓度一定时,适当增大乙醛溶液浓度有利于生成Cu2O。
ⅱ. 乙醛溶液浓度一定时,______。
(3)探究NaOH溶液浓度与乙醛溶液浓度对该反应影响程度的差异。
编号 | 实验Ⅵ | 实验Ⅶ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变黑 | 加热,静置后底部有红色沉淀 |
由以上实验得出推论: ______。
【题目】已知反应:4HCl(g)+O2(g)═2Cl2(g)+2H2O(g),一定条件下测得反应过程中n(Cl2)与时间的关系如表所示:则4~6min内用O2的物质的量变化表示的反应速率是( )
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
n(Cl2)/mol | 0 | 1.2 | 2.6 | 4.4 | 5.4 | 6.0 |
A.7.2molmin-1B.8.0molmin-1C.0.9molmin-1D.0.45molmin-1