题目内容
【题目】(1)烃是一类重要的有机化合物,其结构与性质密切相关。
①下列有机化合物与甲烷互为同系物的是______(填字母) 。
a.乙烯 b.乙烷 c.乙炔
②下列试剂可用于鉴别乙烷和乙烯的是______(填字母) 。
a.水 b.四氯化碳 c.酸性KMnO4溶液
③下列有机化合物易溶于水的是________。
a..苯 b.乙烷 c.乙醇
(2) CH2=CH2、![]() 、CH3CH2OH、CH3COOCH2CH3、CH3COOH、葡萄糖,其中:
、CH3CH2OH、CH3COOCH2CH3、CH3COOH、葡萄糖,其中:
①能通过化学反应使溴水褪色的是____________。
②能发生水解反应的是____________。
③能与新制Cu(OH)2悬浊液反应生成砖红色沉淀的是____________。
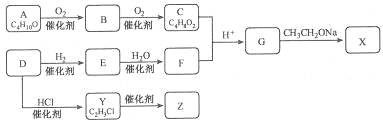
(3)以淀粉为主要原料合成一种具有果香味的物质C合成路线如图所示。
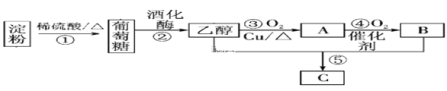
请回答下列问题:
①A的结构简式为____________,
②B分子中的官能团名称为________。
③反应⑤方程式___________________________;
(4)乙烯是石油化工的重要基础原料,工业上可由乙烯与水反应制乙醇,该反应类型为_______,其化学方程式为____________。
【答案】b c c CH2=CH2 CH3COOCH2CH3 葡萄糖 CH3CHO 羧基 CH3COOH+C2H5OH![]() CH3COOC2H5+H2O 加成反应 CH2=CH2+H2O
CH3COOC2H5+H2O 加成反应 CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
【解析】
(1)①结构相似、分子组成相差若干个CH2原子团的有机物互为同系物,与甲烷互为同系物的是乙烷,选b;
②a.乙烷和乙烯都不溶于水,水不能鉴别乙烷和乙烯,故不选a;
B.乙烷和乙烯都溶于四氯化碳,四氯化碳不能鉴别乙烷和乙烯,故不选b;
C.乙烯能使酸性KMnO4溶液褪色,乙烷不能使酸性KMnO4溶液褪色,酸性KMnO4溶液可用于鉴别乙烷和乙烯,故选c;
③a..苯属于烃,难溶于水,故不选a;
B.乙烷属于烃,难溶于水,故不选b;
C.乙醇含有羟基,与水以任意比例互溶,故选c;
(2)①CH2=CH2能与溴水发生加成反应,能通过化学反应使溴水褪色的是CH2=CH2;
②CH3COOCH2CH3含有酯基,能发生水解反应的是CH3COOCH2CH3;
③葡萄糖含有醛基,能与新制Cu(OH)2悬浊液反应生成砖红色沉淀的是葡萄糖;
(3)乙醇氧化为乙醛,乙醛氧化为乙酸,乙醇和乙酸发生酯化反应生成乙酸乙酯;
①乙醇氧化为乙醛,A是乙醛,结构简式为CH3CHO;
②乙醛氧化为乙酸,B是乙酸,结构简式是CH3COOH,分子中的官能团名称为羧基;
③反应⑤是乙酸、乙醇在浓硫酸作用下生成乙酸乙酯和水,反应方程式为CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(4)乙烯与水发生加成反应生成乙醇,反应方程式为CH2=CH2+H2O![]() CH3CH2OH,该反应类型为加成反应。
CH3CH2OH,该反应类型为加成反应。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】下列有关实验的图示及分析均正确的是( )
选项 | 实验目的 | 实验图示 | 实验分析 |
A | 实验室用酸性高锰酸钾溶液滴定草酸溶液 |
| 摇瓶时,使溶液向一个方向做圆运动,勿使瓶口接触到滴定管,溶液也不得溅出 |
B | 石油分馏时接收馏出物 |
| 为收集到不同沸点范围的馏出物,需要不断更换锥形瓶 |
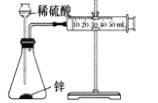
C | 测定锌与稀硫酸反应生成氢气的速率 |
| 实验中需测定的物理量是反应时间和生成氢气的体积 |
D | 用四氯化碳萃取碘水中的碘 |
| 充分震荡后静置,待溶液分层后,先把上层液体从上口倒出,再让下层液体从下口流出 |
A.AB.BC.CD.D
【题目】下表是元素周期表一部分,列出了九种元素在周期表中的位置:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
请用化学用语回答下列问题
(1)在上述元素中,金属性最强的是________。
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是________(填物质化学式)。写出⑥和⑧的最高价氧化物对应的水化物反应的离子方程式________。
(3)只由④形成的18电子微粒。________。
(4)写出②的最高价氧化物的电子式________。
(5)用电子式表示⑦和⑨形成的化合物的形成过程________。
<>(6)表中元素③和⑤可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式________。
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
I.CO2可以被NaOH溶液捕获,若所得溶液c(HCO3-)∶c(CO32-)=2∶1,溶液pH=_____。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
II.CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
(1)已知上述反应中相关的化学键键能数据:
化学键 | C-H | C=O | H-H |
|
键能/kJ/mol | 413 | 745 | 436 | 1075 |
则该反应的ΔH=___________。分别在V L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是___________(填“A”或“B”)。
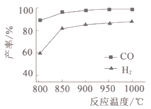
(2)按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图1所示。此反应优选温度为900℃的原因是____________。
(3)在T1温度时,将CH4和CO2各1.0 mol充入2 L密闭恒容容器中,充分反应达到平衡后,若CH4转化率为40%,则
①容器内的压强与起始压强之比为___________;
②此温度下,若该容器中含有CH4、CO2、H2、CO各1.0 mol,则此时反应所处的状态为___________(填“向正反应方向进行中”“向逆反应方向进行中”或“平衡状态”)
③欲使甲烷的平衡转化率提高,应采取的措施是___________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
【题目】化学与生活、生产密切相关,对下列现象或事实解释错误的是( )
选项 | 现象或事实 | 解释 |
A | 《淮南万毕术》中“曾青得铁则化为铜”是现代湿法冶金的基础 | 该变化是置换反应 |
B | 维生素C将食物中不易吸收的Fe3+转化为Fe2+ | 维生素C具有氧化性 |
C | 高铁酸钠(Na2FeO4)是新型消毒剂,3ClO﹣+2Fe3++10OH﹣═2 | 碱性条件下次氯酸钠的氧化性强于高铁酸钠 |
D | 熔融烧碱时,不能用石英坩埚或陶瓷坩埚 | 烧碱可以与二氧化硅发生反应 |
A.AB.BC.CD.D