题目内容
【题目】甲烷是一种重要的化工原料和清洁能源,研究其再生及合理利用有重要意义。
请回答:
(1)已知一定条件下发生如下反应:
CO2(g)+2H2O(g)![]() CH4(g)+2O2(g) △H=+802kJ·mol-1。
CH4(g)+2O2(g) △H=+802kJ·mol-1。
将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
①若甲烷的燃烧热(△H)为-890kJ·mol-1,则水的汽化热△H=___________。(汽化热指1mol液体转化为气体时吸收的热量)
②T1℃、催化剂M作用下,0~20h内该反应速率v(H2O)=___________。
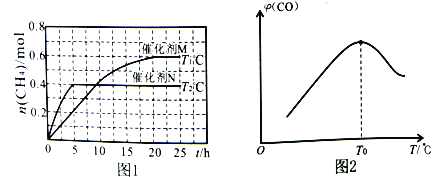
③根据图1判断,T1___________T2(填“>”“<”或“=”),理由为___________。
催化剂的催化效果:M___________N(填“强于”或“弱于”)。
(2)甲烷可用于制备合成气:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(![]() )与温度(T)的关系如图2所示。
)与温度(T)的关系如图2所示。
①T0℃时,CO的体积分数最大的原因为_________________________________。
②若T0℃时,容器内起始压强为p0,CO的平衡体积分数为10%,则反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】+44 kJmol﹣1 0.006 molL﹣1h﹣1 > 该反应为吸热反应,温度升高,CH4的产量增大 弱于 低于T0 ℃时,相同时间段内温度越高反应速率越快,CO的体积分数越大;高于T0 ℃时,反应达到平衡,该反应为放热反应,温度越高CO的体积分数越小 ![]()
【解析】
(1)甲烷的燃烧热为△H=-890kJmol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJmol-1,根据盖斯定律,结合已知热化学方程式处理得H2O(l)=H2O(g),再计算出△H;
②根据图象可知,T1℃、催化剂M作用下,0~20h内甲烷的物质的量变化为0.6mol,结合v=![]() 计算出甲烷的反应速率,然后结合反应速率与化学计量数成正比计算;
计算出甲烷的反应速率,然后结合反应速率与化学计量数成正比计算;
③根据催化剂不影响平衡,会使得化学反应速率增大,结合该反应为放热反应分析解答;
(2)①没有达到平衡状态时,温度越高反应速率越快,当达到平衡状态后,升高温度平衡向着逆向移动,据此分析;
②CH4(g)和H2O(g)的物质的量之比为1∶3,设CH4为xmol,H2O为3xmol,平衡时生成的CO为ymol,然后根据三段式分析解答。容器容积相同时,气体的压强与物质的量成正比,T0℃时,容器内起始压强为p0,计算出平衡时的压强,再分别计算出平衡时各气体的分压,带入平衡常数表达式计算即可。
(1)①已知:CO2(g)+2H2O(g)CH4(g)+2O2(g)△H=+802kJmol﹣1①,甲烷的燃烧热为△H=﹣890kJmol﹣1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890 kJmol﹣1②,根据盖斯定律,﹣![]() (①+②)可得:H2O(l)=H2O(g)△H=﹣
(①+②)可得:H2O(l)=H2O(g)△H=﹣![]() [+802kJmol﹣1+(﹣890 kJmol﹣1)]=+44 kJmol﹣1,故答案为:+44 kJmol﹣1;
[+802kJmol﹣1+(﹣890 kJmol﹣1)]=+44 kJmol﹣1,故答案为:+44 kJmol﹣1;
②根据图像可知,T1℃、催化剂M作用下,0~20h内水的物质的量变化为0.6mol,则v(CH4)=0.003 molL﹣1h﹣1,所以v(H2O)=2v(CH4)=0.006 molL﹣1h﹣1,故答案为:0.006 molL﹣1h﹣1;
③该反应为吸热反应,温度升高,CH4的产量增大,根据图像可知,温度为T1条件下,平衡时甲烷的物质的量较大,则T1>T2;已知温度T1>T2,若不使用催化剂,应该在温度T1条件下优先达到平衡状态,根据图像可知,使用催化剂N的曲线优先达到平衡状态,说明催化剂的催化效果:M弱于N,故答案为:>;该反应为吸热反应,温度升高,CH4的产量增大;弱于;
(2)①在温度低于T0 ℃时,相同时间段内温度越高反应速率越快,则CO的体积分数越大;在温度为T0 ℃时,反应达到平衡,由于该反应为放热反应,温度越高CO的体积分数越小,所以T0℃时CO的体积分数最大,故答案为:低于T0 ℃时,相同时间段内温度越高反应速率越快,CO的体积分数越大;高于T0 ℃时,反应达到平衡,该反应为放热反应,温度越高CO的体积分数越小;
②CH4(g)和H2O(g)的物质的量之比为1∶3,设CH4为xmol,H2O为3xmol,平衡时生成的CO为ymol,CO的平衡体积分数为10%
CH4(g)+H2O(g)CO(g)+3H2(g)
初始(mol) x 3x 0 0
转化(mol) y y y 3y
平衡(mol) x﹣y 3x﹣y y 3y
则:![]() ×100%=10%,解得:y=0.5x,平衡时混合气体的总物质的量为:x-0.5x+3x-0.5x+0.5x+0.5x×3=5x,反应前总物质的量为4xmol,容器容积相同时,气体的压强与物质的量成正比,T0℃时,容器内起始压强为p0,则平衡时压强为:p0×
×100%=10%,解得:y=0.5x,平衡时混合气体的总物质的量为:x-0.5x+3x-0.5x+0.5x+0.5x×3=5x,反应前总物质的量为4xmol,容器容积相同时,气体的压强与物质的量成正比,T0℃时,容器内起始压强为p0,则平衡时压强为:p0×![]() =1.25p0,平衡时p(CH4)=
=1.25p0,平衡时p(CH4)=![]() ×1.25p0=
×1.25p0=![]() p0,p(H2O)=
p0,p(H2O)=![]() ×1.25p0=
×1.25p0=![]() p0,p(CO)=
p0,p(CO)=![]() ×1.25p0=
×1.25p0=![]() p0,p(CH4)=
p0,p(CH4)=![]() ×1.25p0=
×1.25p0=![]() p0,反应的平衡常数Kp=
p0,反应的平衡常数Kp=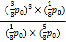 =
=![]() ,故答案为:
,故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案