��Ŀ����
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ���ҵ�������������Ҫ�����У�
��1����ӦN2��g��+3H2��g��2NH3��g����H��0������ʱ����N2��H2�Ļ���������2L�ܱ������У�10���Ӻ�Ӧ�ﵽƽ�⣬ͼ1ͼ������ȷ��ʾ�ù�����������ı仯���� �� ��ѡ����ĸ���� 
��2��һ���¶��£����ܱ������г���1molN2��3molH2������Ӧ���������ݻ��㶨���ﵽƽ��״̬ʱ������������ʵ�����ԭ���� ![]() ����N2��ת����a1=��������������ټ���1molN2��3molH2 �� �ﵽƽ��״̬ʱ��N2��ת����Ϊa2 �� ��a2a1�����������������=������
����N2��ת����a1=��������������ټ���1molN2��3molH2 �� �ﵽƽ��״̬ʱ��N2��ת����Ϊa2 �� ��a2a1�����������������=������
��3��2NO��g��+O2��g��2NO2��g����������������ͬʱ���ֱ���NO��ƽ��ת�����ڲ�ͬѹǿ��P1��P2�����¶ȱ仯�����ߣ���ͼ2���� �ٱȽ�P1��P2�Ĵ�С��ϵ��P1P2�����������������=������
�����¶����ߣ��÷�Ӧƽ�ⳣ���仯�������� ��
��4�����᳧��������2�ַ�������β���� �ٴ���ԭ������������ʱ��H2��NO2��ԭΪN2 ��
��֪��2H2��g��+O2��g���T2H2O��g����H=��483.6kJ/mol
N2��g��+2O2��g���T2NO2��g����H=+67.7kJ/mol
��H2��ԭNO2����ˮ������Ӧ���Ȼ�ѧ����ʽ�� ��
�ڼ�Һ���շ�����Na2CO3��Һ����NO2����CO2 �� ��ÿ4.6gNO2��Na2CO3��Һ��Ӧʱת�Ƶ�����Ϊ0.05mol����Ӧ�����ӷ���ʽ�� ��
���𰸡�
��1��ab
��2��60%����
��3��������С
��4��4H2��g��+2NO2��g��=N2��g��+4H2O��g����H=��1034.9kJ/mol��2NO2+CO32��=NO3��+NO2��+CO2
���������⣺��1������ʱ����N2��H2�Ļ���������2L�ܱ������У�10���Ӻ�Ӧ�ﵽƽ��ʱ����Ӧ���ȣ��淴Ӧ��С���ʼ��������ȼ��٣�����������䣬��������ܶȲ��䣬��Ӧ������У���������������䣬�����ʵ������٣���������ƽ����Է�������������ʼ��Ϊ0��
���Դ��ǣ�ab����2��
N2+ | 3H2= | 2NH3 | |
��ʼ��mol�� | 1 | 3 | 0 |
ת����mol�� | x | 3x | 2x |
ƽ�⣨mol�� | 1��x | 3��3x | 2x |
��1��x��+��3��3x��+2x=��1+3���� ![]()
���x=0.6mol����N2��ת����a1= ![]() ��100=60%��
��100=60%��
������������ټ���1molN2��3molH2��ѹǿ����ƽ�������ƶ���ת����������a2��a1��
���Դ��ǣ�60%��������3������֪2NO��g��+O2��g��2N02��g���������������С�ķ�Ӧ������ѹǿƽ�����ƣ���NO��ת���ʻ�������ͼ��֪p2ʱNO��ת���ʴ���p2ʱѹǿ��p1��p2�����Դ��ǣ�����
����ͼ��2��֪�������¶ȵ����ߣ�NO��ת���ʼ�С��˵�������¶�ƽ�����ƣ���÷�Ӧ�������Ƿ��ȷ�Ӧ�����������¶�ƽ�ⳣ��K��С�����Դ��ǣ���С����4����a.2H2��g��+O2��g���T2H2O��g����H=��483.6kJ/mol
b��N2��g��+2O2��g���T2NO2��g����H=+67.7kJ/mol
�ɸ�˹���ɿ�֪��a��2��b�õ�4H2��g��+2NO2��g��=N2��g��+4H2O��g������H2��ԭNO2����ˮ������Ӧ���Ȼ�ѧ����ʽΪ4H2��g��+2NO2��g��=N2��g��+4H2O��g����H=��1034.9kJ/mol��
���Դ��ǣ�4H2��g��+2NO2��g��=N2��g��+4H2O��g����H=��1034.9kJ/mol��
����Na2CO3��Һ����NO2����CO2��CԪ�صĻ��ϼ۲��䣬ÿ4.6gNO2��Na2CO3��Һ��Ӧʱת�Ƶ�����Ϊ0.05mol��n��NO2��= ![]() =0.1mol����֪NԪ�صĻ��ϼ���+4�۽���Ϊ+3�ۣ���+4������Ϊ+5�ۣ����ӷ�ӦΪ2NO2+CO32��=NO3��+NO2��+CO2�����Դ��ǣ�2NO2+CO32��=NO3��+NO2��+CO2��
=0.1mol����֪NԪ�صĻ��ϼ���+4�۽���Ϊ+3�ۣ���+4������Ϊ+5�ۣ����ӷ�ӦΪ2NO2+CO32��=NO3��+NO2��+CO2�����Դ��ǣ�2NO2+CO32��=NO3��+NO2��+CO2��
�����㾫����ͨ��������û�ѧƽ��ļ��㣬���շ�Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%�����Խ����⣮

 ��ѧ����ϵ�д�
��ѧ����ϵ�д�����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��CO��g��+H2O��g��CO2��g��+H2��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ�����
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK= �� �÷�ӦΪ��Ӧ�������Ȼ���ȣ��� ���ı�����ʹƽ��������Ӧ�����ƶ�����ƽ�ⳣ��������ţ�
��һ������ ��һ����С �ۿ������� ������С��������п���
��2�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬�������� �� ��a��������ѹǿ���� ��b�����������c��CO������
��c��v����H2��=v����H2O�� ��d��c��CO��=c��CO2��
��3������ͬ����CO ��g�� ��H2O ��g�� �ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO ��g��+H2O ��g��CO2��g��+H2��g�����õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
H2O | CO | CO2 | CO | |||
A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
C | 900 | a | b | c | d | t |
��ʵ��A���Ԧԣ�H2�� ��ʾ�ķ�Ӧ����Ϊ
��ͨ�������֪��CO��ת����ʵ��Aʵ��B������ڡ��������ڡ���С�ڡ������÷�Ӧ������ӦΪ��������š����ȷ�Ӧ��
����ʵ��CҪ�ﵽ��ʵ��B��ͬ��ƽ��״̬����a��bӦ����Ĺ�ϵ�����ú�a��b����ѧʽ��ʾ����
����Ŀ�����շ�����һ�ְ�ɫ���壬������ˮ�������ڻ�е�豸���������������̿���Ҫ�ɷ�ΪMnO2 �� ������������Fe2O3��FeO��Al2O3��Ϊԭ���Ʊ����շ��ε�������ͼ�� 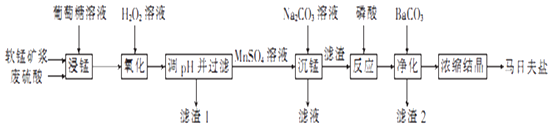
��1�����̿�Ҫ���Ƴɿ�Ŀ���� �� �����ǣ�C6H12O6����MnO2��Ӧʱ������ΪMnSO4��CO2��H2O���÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ ��
��2����H2O2��Һ��������ʱ������Ӧ�����ӷ���ʽΪ ��
��3����֪���ֽ������ӵ��������↑ʼ��������ȫ������pH�����ʾ������pH�����ˡ�ʱ��Ӧ������pH��ΧΪ �� ����1����Ҫ�ɷ�Ϊ���ѧʽ����
�������� | ��ʼ������pH | ��ȫ������pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
��4���������������Ӧ�Ļ�ѧ����ʽΪ ��
��5��ij���������������Ʊ����շ��Σ���֪���̿���MnO2�ĺ���Ϊ87%��������������Ԫ�ص������Ϊ9%����1t�����̿���Ƶ����շ���t��
����Ŀ��ij�¶��£���Ӧ 2CH3OH��g�� ![]() CH3OCH3��g��+H2O��g����ƽ�ⳣ��Ϊ400�����¶��£����ݻ�һ�����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
CH3OCH3��g��+H2O��g����ƽ�ⳣ��Ϊ400�����¶��£����ݻ�һ�����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
���� | CH3OH | CH3OCH3 | H2O |
Ũ��/��molL��1�� | 0.44 | 0.6 | 0.6 |
����˵����ȷ���ǣ� ��
A.CH3OH����ʼŨ��Ϊ1.04mol/L
B.��ʱ�淴Ӧ���ʴ�������Ӧ����
C.ƽ��ʱCH3OH��Ũ��Ϊ0.04mol/L
D.ƽ��ʱCH3OH��ת����С��80%
