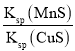题目内容
【题目】关于如图所示的原电池,下列说法正确的是( )
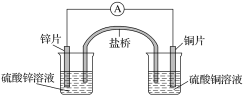
A. 电子从锌电极通过电流表流向铜电极
B. 盐桥中的阴离子向硫酸铜溶液中迁移
C. 锌电极发生氧化反应;铜电极发生还原反应,其电极反应是2H++2e-===H2↑
D. 取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
【答案】A
【解析】
该原电池中,Zn失电子作负极,负极电极反应式为Zn-2e-=Zn2+;Cu作正极,正极电极反应式为Cu2++2e-=Cu,电子从负极沿导线流向正极,盐桥中阳离子向正极移动、阴离子向负极移动,据此分析解答。
A.锌作负极、铜作正极,电子从锌电极通过电流计流向铜电极,故A正确;
B.Zn易失电子作负极、Cu作正极,阴离子向负极移动,则盐桥中阴离子向硫酸锌溶液迁移,故B错误;
C.铜电极上铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu,故C错误;
D.取出盐桥后,不能形成闭合回路,不能形成原电池,电流计指针不发生偏转,故D错误;
答案选A。

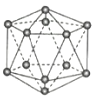
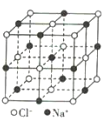
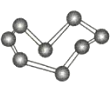
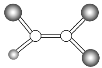
【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
晶体硼(其每个结构单元中有12个B原子) | NaCl | S8 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点2573K | —— | 易溶于CS2 | —— |
A.晶体硼属于原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.NaCl晶体中每个Na+周围距离最近且相等的Na+有6个
C.S8分子中的共价键为非极性键
D.HCN分子中含有2个σ键,2个π键
【题目】下列实验操作、现象、结论均完全正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 在常温下测定Na2CO3和NaHCO3溶液的pH | Na2CO3溶液pH较大 | 水解能力:Na2CO3大于NaHCO3 |
B | 先向盛有1mL 0.1mol/L的AgNO3溶液的试管中滴加两滴0.1mol/L的NaCl溶液,再向其中滴加0.1mol/L的NaI溶液。 | 滴加NaCl溶液有白色沉淀生成,滴加NaI溶液后有黄色沉淀生成 | AgCl沉淀可转化成AgI沉淀 |
C | 电解饱和CuCl2溶液实验中,用润湿的淀粉—碘化钾试纸靠近阳极 | 润湿的淀粉—碘化钾试纸变蓝 | 阳极产生Cl2 |
D | 饱和FeCl3溶液中加入少量NaCl固体 | 溶液颜色变浅 | 加入NaCl固体后,FeCl3的水解平衡逆向移动 |
A. AB. BC. CD. D