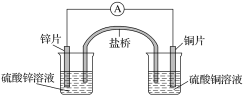
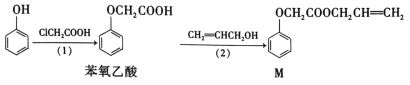
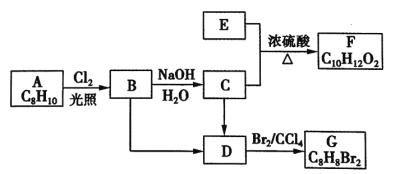
题目内容
【题目】有一瓶澄清的溶液,其中可能含H+、![]() 、K+、Al3+、Cu2+、Fe3+、
、K+、Al3+、Cu2+、Fe3+、![]() 、I- 中的一种或几种,取该溶液进行如下实验:
、I- 中的一种或几种,取该溶液进行如下实验:
①用pH试纸检验,表明溶液呈强酸性。
②取部分溶液,加入数滴新制的氯水及少量的CC14,振荡后CC14层显紫色。
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中有白色沉淀生产,后白色沉淀完全消失。
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实回答:
(1) 在溶液中,肯定存在的离子有_______,肯定不存在的离子有______ 。
(2) 不能确定是否存在的离子有______。证明它(们)是否存在的实验方法是______。
(3)写出步骤②涉及的离子方程式,并用单线桥标出电子转移的方向和数目______ 。
(4)写出步骤④涉及的离子方程式 ______ 。
【答案】H+、Al3+、I-、![]() Cu2+、Fe3+、
Cu2+、Fe3+、![]() K+ 焰色反应
K+ 焰色反应 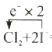 = I2 + 2Cl- NH3·H2O
= I2 + 2Cl- NH3·H2O![]() NH3↑+H2O
NH3↑+H2O
【解析】
①用pH试纸检验,溶液呈强酸性,则溶液中含有H+,不含有CO32-;
②取部分溶液,加入数滴新制的氯水及少量的CC14,振荡后CC14层显紫色,说明有I-,无Cu2+、Fe3+;
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中有白色沉淀生产,后白色沉淀完全消失,证明含有Al3+;
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,该气体为NH3,说明含有NH4+;
据此分析解答问题。
(1)由上述分析可知,溶液中肯定存在的离子是H+、Al3+、I-、![]() ,一定不存在的离子是Cu2+、Fe3+、
,一定不存在的离子是Cu2+、Fe3+、![]() ,故答案为:H+、Al3+、I-、
,故答案为:H+、Al3+、I-、![]() ;Cu2+、Fe3+、
;Cu2+、Fe3+、![]() ;
;
(2)上述所有实验中无法确定是否含有K+,可以通过焰色反应验证是否含有K+,故答案为:K+;焰色反应;
(3)步骤②为Cl2氧化I-为I2,反应的离子方程式为Cl2+2I-===2Cl-+I2,用单线桥法标出电子转移方向为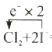 = I2 + 2Cl-,故答案为:
= I2 + 2Cl-,故答案为: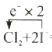 = I2 + 2Cl-;
= I2 + 2Cl-;
(4)步骤④为NH3·H2O受热分解,反应方程式为NH3·H2O![]() NH3↑+H2O,故答案为:NH3·H2O
NH3↑+H2O,故答案为:NH3·H2O![]() NH3↑+H2O。
NH3↑+H2O。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】草酸是草本植物常具有的成分。查阅相关资料得到草酸晶体(H2C2O4·3H2O)及其盐的性质如表。
熔沸点 | 颜色与溶解性 | 部分化学性质 | 盐 |
熔点:101-102℃ 沸点:150-160℃升华 | 草酸晶体无色,易溶于水 | 100.1℃受热脱水,175℃以上分解成气体;具有还原性 | 草酸钙盐难溶于水 |
(1)草酸晶体(H2C2O4·3H2O)175℃以上会发生分解生成三种氧化物,某实验小组欲通过实验证明这三种氧化物。
①该小组选用装置丙作为分解装置,不选用甲装置的原因是_______。丙装置相对于乙装置的优点是________。实验前检验该装置气密性的操作方法是________。
甲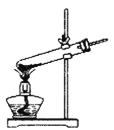 乙
乙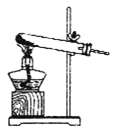 丙
丙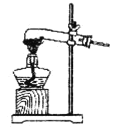
②从图中选用合适的装置,验证分解产生的气体,装置的连接顺序是______________。(用装置编号表示,某些装置可以重复使用,也可以装不同的试剂)
B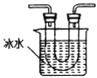 C
C D
D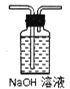 E
E![]() F
F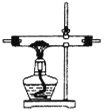
③B装置的作用是__________。
(2)某实验小组称取4.0g粗草酸晶体配成100mL溶液,采用0.1mol·L-1酸性高锰酸钾溶液滴定该草酸溶液,测定该草酸晶体的纯度。
①配制草酸溶液需要用到的主要玻璃仪器有_______________。
②本实验达到滴定终点的标志是___________。
③将所配草酸分为四等份,实验测得每份平均消耗酸性高锰酸钾溶液20mL。计算该粗草酸中含草酸晶体的质量为_______g(保留两位有效数字)。
【题目】五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
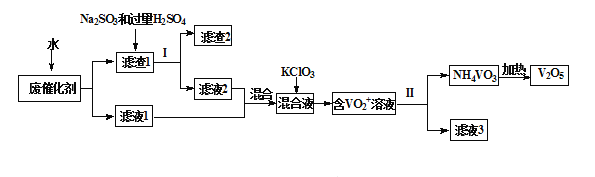
已知:a.部分含钒物质常温下在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
b.![]() +2OH-
+2OH-![]()
![]() +H2O
+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为_________(写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为_______________(填离子符号)。
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式为_____________。
(4)生成VO2+的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式为________________
(5)结合化学用语,用平衡移动原理解释加入氨水的一种作用为__________________
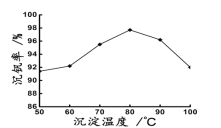
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。请解释下图温度超过80℃以后,沉钒率下降的可能原因是________________________;___________________(写两条)。
(7)该工艺流程中可以循环利用的物质为__________________。
(8)测定产品中V2O5的纯度:称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L1 (NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+==VO2++Fe3++H2O)。最后用c2 mol·L1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182 g·mol1)的质量分数是______。(列出计算式)