题目内容
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
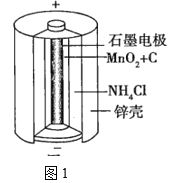
(1)锌锰干电池是应用最普遍的电池之一,图1为锌锰干电池的构造示意图,锌锰干电池的负极材料是___(填物质名称),负极发生的电极反应为___。若反应消耗32.5g负极材料,则电池中转移电子的数目为___。
(2)目前常用的镍-镉(Ni—Cd)可充电电池的总反应式可表示为Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是___(填序号)。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是___(填序号)。
①该电池可以在酸性条件下进行充、放电。
②该电池放电时,负极的电极反应式为Cd+2OH--2e-=Cd(OH)2
③该电池放电时,Cd极的质量减少
④该电池放电时,化学能转变为电能。
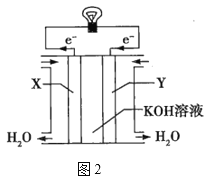
(3)图2为氢氧燃料电池的构造示意图,电解质溶液是KOH溶液。则X极为电池的__(填“正”或“负”)极,X极的电极反应式为___。
【答案】锌 Zn-2e-=Zn2+ 6.02×1023 ②④ 负 H2-2e-+2OH-=2H2O
【解析】
锌锰干电池是应用最普遍的电池之一,锌为负极,发生氧化反应;镍-镉(Ni—Cd)可充电电池,放电为原电池,充电为电解池,氢氧燃料电池属于新型电池,氢气做负极,发生氧化反应,氧气在正极发生还原反应,在分析和书写极反应时,要注意电解质溶液的性质。
(1)负极发生氧化反应,锌失去电子被氧化,所以负极材料为锌,电极反应式为Zn-2e-=Zn2+,32.5g锌的物质的量为0.5mol,1mol锌参与反应失去2mol电子,所以32.5g锌参与反应时转移电子的物质的量为1mol,数目为6.021023。
答案为:锌;Zn-2e-=Zn2+;6.021023。
(2)①Ni(OH)2与Cd(OH)2可以与酸反应,则该电池不能在酸性条件下进行充、放电,①错误;
②电池放电时,负极的电极反应式为Cd+2OH--2e-=Cd(OH)2,②正确;
③电池放电时,Cd为负极,发生氧化反应生成Cd(OH)2,Cd极的质量增加,③错误;
④该电池放电时为原电池,化学能转化为电能,④正确。
答案选②④。
(3)电解质溶液为KOH溶液,X电极上失去电子,为负极,氢气在负极失电子被氧化,电极反应式为:H2+2OH--2e-=2H2O。
答案为:H2+2OH--2e-=2H2O。