题目内容
【题目】二氧化氯(ClO2)是易溶于水且不与水反应的黄绿色气体,沸点为11℃。某小组在实验室中制备ClO2的装置如下:[已知:SO2+2NaClO3+H2SO4=2ClO2 +2NaHSO4]
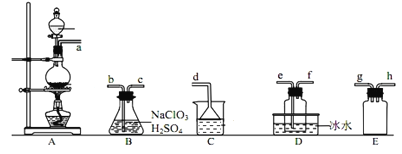
下列说法正确的是
A.装置C中装的是饱和食盐水,a逸出的气体为SO2
B.连接装置时,导管口a应接h或g,导管口c应接e
C.装置D放冰水的目的是液化SO2,防止污染环境
D.可选用装置A利用1mol·L1盐酸与MnO2反应制备Cl2
【答案】B
【解析】
利用A装置制取SO2,在B中发生制取反应得到ClO2,ClO2的沸点为11℃,利用冰水浴冷凝,可在装置D中收集到ClO2;E为安全瓶,防B中的液体进入到A中,E放置在A与B之间。C为尾气吸收装置,吸收多余的SO2。
A、利用A装置制取SO2,a逸出的气体为SO2,C为尾气吸收装置,用于吸收多余的SO2,应该装有NaOH溶液,A错误;
B、利用A装置制取SO2,在B中发生制取反应得到ClO2,E为安全瓶,防B中的液体进入到A中,E放置在A与B之间,所以a应接h或g;装置D中收集到ClO2,导管口c应接e,B正确;
C、ClO2的沸点11℃,被冰水浴冷凝,在D中收集到,C错误;
D、MnO2有浓盐酸反应,1mol·L-1并不是浓盐酸,D错误;
答案选B。

【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断正确的是( )
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
A.实验①反应后的溶液中:c(A﹣)>c(K+)>c(OH﹣)>c(H+)
B.实验①反应后的溶液中:c(OH﹣)=c(K+)﹣c(A﹣)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A﹣)+c(HA)<0.1 mol/L
D.实验②反应后的溶液中:c(K+)+c(OH﹣)=c(H+)+c(A﹣)