题目内容
10.下列氢化物中,最稳定的是( )| A. | HCl | B. | HI | C. | NH3 | D. | HF |
分析 元素的非金属性越强,其氢化物的稳定性越强,同一周期,元素的非金属性随着原子序数增大而增强,同一主族,元素的非金属性随着原子序数增大而减弱,据此分析解答.
解答 解:元素的非金属性越强,其氢化物的稳定性越强,同一周期,元素的非金属性随着原子序数增大而增强,同一主族,元素的非金属性随着原子序数增大而减弱,这几种元素非金属性F>Cl>N>I,所以HF的稳定性最强,故选D.
点评 本题以氢化物的稳定性为载体考查元素非金属性强弱判断,元素非金属性强弱与得电子难易程度有关,与得电子多少无关,题目难度不大.

练习册系列答案
相关题目
20.某种具有较好耐热性、耐水性和高频电绝缘性的高分子化合物的结构片断为:
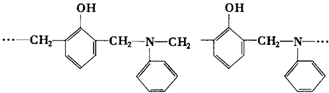
则生成该树脂的单体(其中一种为甲醛)的种数和化学反应所属类型正确的是( )

则生成该树脂的单体(其中一种为甲醛)的种数和化学反应所属类型正确的是( )
| A. | 2种,取代和加聚反应 | B. | 2种,加成和缩聚反应 | ||
| C. | 3种,取代和加聚反应 | D. | 3种,加成和缩聚反应 |
1.常温下,某CH3COONa与CH3COOH的混合溶液的pH=7,则下列离子浓度之间的关系错误的是( )
| A. | c(Na+)>c(CH3COO-) | B. | c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | ||
| C. | c(Na+)<c(CH3COO-) | D. | c(Na+)<c(CH3COO-)+c(OH-) |
18.使用下列能源会对环境造成污染的是( )
| A. | 风能 | B. | 石油 | C. | 氢能 | D. | 太阳能 |
15.下列物质易溶于水的是( )
| A. | 葡萄糖 | B. | 油脂 | C. | 苯 | D. | 乙烯 |
2.已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为( )
| A. | 4v(NH3)=5v(O2) | B. | 5v(O2)=6v(H2O) | C. | 4v(O2)=5v(NO) | D. | 2v(NH3)=3v(H2O) |
19.a、b、c、d、e、f、g为七种由短期周期元素构成的粒子,它们都有10个电子,其结构特点如下:
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可反应生成两个共价型g分子.
试写出:
(1)d分子的空间构型为三角锥形.
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:NaOH>Mg(OH)2 (用化学式表示).
(3)d溶于水的电离方程式NH3+H2O?NH3•H2O?NH4++OH-.
(4)g粒子所构成的晶体类型属分子晶体.
(5)c粒子是OH-,f粒子是H3O+(都用化学式表示).
| 粒子代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 单位电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
试写出:
(1)d分子的空间构型为三角锥形.
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:NaOH>Mg(OH)2 (用化学式表示).
(3)d溶于水的电离方程式NH3+H2O?NH3•H2O?NH4++OH-.
(4)g粒子所构成的晶体类型属分子晶体.
(5)c粒子是OH-,f粒子是H3O+(都用化学式表示).
20.下列措施或事实不能用勒夏特列原理解释的是( )
| A. | 新制的氯水在光照下颜色变浅 | |
| B. | H2、I2、HI平衡混合气减小压强(扩大体积)可使颜色变浅 | |
| C. | 打开汽水瓶盖,有气泡冒出 | |
| D. | 在合成氨的反应中,加压有利于氨的合成 |