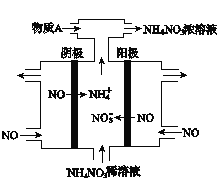
题目内容
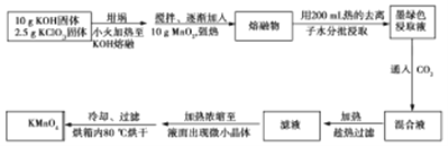
【题目】(12分)以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2-2.9 | 2.8-3.1 | 22-28 | 60-65 | 1-2 | <1 |
以下是一种废钒催化剂回收工艺路线:
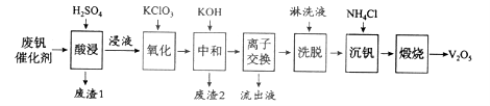
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
【答案】
(1)V2O5+2H+=2VO2++H2O;SiO2
(2)0.5;
(3)Fe(OH)3、Al(OH)3;
(4)碱;
(5)2NH4VO3![]() V2O5+H2O+2NH3↑
V2O5+H2O+2NH3↑
【解析】
试题分析:从废钒催化剂中回收V2O5,由流程可知,“酸浸”时V2O5转化为VO2+,V2O4转成VO2+.氧化铁、氧化铝均转化为金属阳离子,只有SiO2不溶,则过滤得到的滤渣1为SiO2,然后加氧化剂KClO3,将VO2+变为VO2+,再加KOH时,铁离子、铝离子转化为Fe(OH)3、Al(OH)3沉淀,同时中和硫酸,过滤得到的滤渣2为Fe(OH)3、Al(OH)3,“离子交换”和“洗脱”可简单表示为:4ROH+V4O124-![]() R4V4O12+4OH-,由ROH为强碱性阴离子交换树脂可知,碱性条件下利用反应正向移动,流出液中主要为硫酸钾,“沉钒”得到偏钒酸铵(NH4VO3)沉淀,“煅烧”时分解生成V2O5。
R4V4O12+4OH-,由ROH为强碱性阴离子交换树脂可知,碱性条件下利用反应正向移动,流出液中主要为硫酸钾,“沉钒”得到偏钒酸铵(NH4VO3)沉淀,“煅烧”时分解生成V2O5。
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为V2O5+2H+=2VO2++H2O,由上述分析可知滤渣1为SiO2,故答案为:V2O5+2H+=2VO2++H2O;SiO2;
(2)“氧化”中欲使3 mol的VO2+变为VO2+,由电子守恒可知,则需要氧化剂KClO3至少为![]() =0.5mol,故答案为:0.5;
=0.5mol,故答案为:0.5;
(3)由上述流出分析可知滤渣2为Fe(OH)3、Al(OH)3,故答案为:Fe(OH)3、Al(OH)3;
(4)利用强碱性阴离子交换树脂可“离子交换”和“洗脱”,则应选择碱性条件下使用,且OH-浓度大反应逆向移动提高洗脱效率,故答案为:碱;
(5)“煅烧”中发生反应的化学方程式为2NH4VO3![]() V2O5+H2O↑+2NH3↑,故答案为:2NH4VO3
V2O5+H2O↑+2NH3↑,故答案为:2NH4VO3![]() V2O5+H2O↑+2NH3↑。
V2O5+H2O↑+2NH3↑。

 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案