题目内容
【题目】【化学选修2:化学与技术】(15分)
(1)一种从废的镀金黄铜零件中回收金的方法:先将零件磨碎,将粉末加入H2SO4和KNO3的混合溶液中,浸泡数小时后,使其完全溶解,然后将沉淀物滤出。上述方法中,将废料磨碎的目的是_________,溶出铜的离子方程式为____________________。
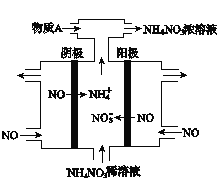
(2)工业上采用电解法处理NO制备NH4NO3。工作原理如图所示,则阳极的电极反应式为________,通入的物质X的化学式为____________,若电路中通过15mol电子,则理论上最多可制备NH4NO3的物质的量为_________。
(3)如图是从含有CuCl2的酸性蚀刻液中制取无机催化剂CuCl的流程:

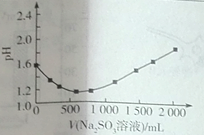
①反应I进行时,反应体系的pH与Na2SO3溶液的添加量的关系如图所示,则反应I的离子方程式为________。
②过滤后的物质用含乙醇的洗涤液洗涤,原因是_________________。
③准确称取0.25gCuCl样品置于一定量的FeCl3溶液中,待样品完全溶解后,加水至20mL,用0.050mol/L的K2Cr2O7标准溶液滴定至终点,消耗8.12mLK2Cr2O7溶液,则该样品中CuCl的质量分数为_________。
【答案】(1)增大反应物的接触面积,加快反应速率和提高铜、锌的浸出率(1分) ;
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(2分);
(2)NO-3e-+2H2O=4H++NO3-(2分);NH3(2分);5mol(2分);
(3) ①2Cu2++2Cl-+SO32-+H2O=2CuCl↓+SO42-+2H+ (2分);②减少CuCl的溶解,降低损耗(2分);③ 97.0%(2分)。
【解析】
试题分析:(1)将矿石研磨粉碎目的是增大反应物的接触面积,加快化学反应速率,提高铜、铁的浸出率;加入H2SO4和KNO3的混合溶液中,相当于加入了稀硝酸,硝酸具有强的氧化性,与Cu发生氧化还原反应,方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O ;(2)根据图示可知阳极的电极反应式是:NO-3e-+2H2O=4H++NO3-;阴极的电极反应式是:NO+5e-+6H+=NH4++H2O;根据电子转移守恒可知当电路中通过15mol电子时,生成5molNO3-、3molNH4+,若将氮元素全部转化为硝酸铵,则需要补充2molNH3,可制备5mol硝酸铵。(3) ① Cu2+具有氧化性,SO32-具有还原性,它们在水溶液中发生氧化还原反应2Cu2++2Cl-+ SO32-+ H2O=2CuCl↓+SO42-+2H+,②过滤后的物质用含乙醇的洗涤液洗涤,原因是CuCl在水中溶解度比在乙醇中的小,用乙醇溶解就可以减少CuCl的的溶解,降低损耗;③溶解CuCl的反应方程式是:CuCl+Fe3+=Cu2++Cl-+Fe2+,滴定时反应为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,根据方程式可得关系式:6CuCl~K2Cr2O7,则样品中CuCl的质量是m(CuCl)=0.050mol/L×0.00812L×6×99.5g/mol=0.24238g,则其质量分数是(0.24238g÷0.25g)×100%=97.0%。