题目内容
5.0.1mol•L-1 AgNO3溶液在以Ag作阳极、Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断正确的是( )| A. | 溶液的浓度变为0.08 mol•L-1 | B. | 阳极上产生112 mL O2(标准状况) | ||
| C. | 转移的电子数是1.204×1022 | D. | 反应中有0.02 mol的Ag被氧化 |
分析 A.Ag作阳极、Fe作阴极电解 AgNO3溶液,阳极材料和电解质溶液中金属阳离子相同,所以该装置是电镀池;
B.阳极上电极反应式为Ag-e-=Ag+;
C.阴极上析出Ag,生成n(Ag)=$\frac{2.16g}{108g/mol}$=0.02mol,根据Ag和转移电子之间的关系式计算;
D.该装置是电镀池,则阳极溶解的Ag物质的量等于阴极析出Ag的物质的量.
解答 解:A.Ag作阳极、Fe作阴极电解 AgNO3溶液,阳极材料和电解质溶液中金属阳离子相同,所以该装置是电镀池,电解过程中阳极溶解的Ag物质的量等于阴极析出Ag物质的量,所以溶液浓度不变,故A错误;
B.阳极上电极反应式为Ag-e-=Ag+,所以没有氧气生成,故B错误;
C.阴极上析出Ag,生成n(Ag)=$\frac{2.16g}{108g/mol}$=0.02mol,根据Ag++e-=Ag知,转移电子的个数为1.204×1022,故C正确;
D.该装置是电镀池,则阳极溶解的Ag物质的量等于阴极析出Ag的物质的量,阳极上Ag失电子被氧化,反应中有0.02 mol的Ag被氧化,故D正确;
故选CD.
点评 本题以电解原理为载体考查物质的量的有关计算及电镀,明确电镀特点是解本题关键,注意:电解池中阳极材料是活泼金属时,阳极上金属失电子而不是电解质溶液中阴离子失电子,为易错点.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
15.1,5-戊二醛(简称GA)是一种重要的饱和直链二元醛.2%的GA溶液对禽流感、口蹄疫等疾病有良好的防治作用.根据上述信息,判断下列说法中正确的是( )
| A. | 戊二醛的分子式为C5H8O2,符合此分子式的二元醛有5种 | |
| B. | 戊二醛不能使酸性高锰酸钾溶液褪色 | |
| C. | 戊二醛经催化氧化可以得到的戊二酸有4种同分异构体 | |
| D. | 1mol的戊二醛与足量的银氨溶液反应,最多可得2mol单质银 |
16.漆酚液体多来自于松脂毒藤和与其相关的植物.漆酚在植物损伤后的树汁中存在;或在深秋,植物树汁流出后,表面(漆酚氧化)后成为黑色的地方.漆酚 是生漆的主要成分,黄色能溶于有机溶剂中.生漆涂在物体表面,能在空气中干燥转变为黑色漆膜,下列有关其化学性质的叙述不正确的是( )
是生漆的主要成分,黄色能溶于有机溶剂中.生漆涂在物体表面,能在空气中干燥转变为黑色漆膜,下列有关其化学性质的叙述不正确的是( )
 是生漆的主要成分,黄色能溶于有机溶剂中.生漆涂在物体表面,能在空气中干燥转变为黑色漆膜,下列有关其化学性质的叙述不正确的是( )
是生漆的主要成分,黄色能溶于有机溶剂中.生漆涂在物体表面,能在空气中干燥转变为黑色漆膜,下列有关其化学性质的叙述不正确的是( )| A. | 能发生氧化反应 | B. | 与FeCl3溶液发生显色反应 | ||
| C. | 能发生取代反应和加成反应 | D. | 与足量浓溴水反应时,消耗溴4mol |
13.下表列出了某短周期元素R的各级电离能数据(用I1、I2…表示,单位为kJ•mol-1).下列关于元素R的判断中一定正确的是( )
①R的最高正价为+3价
②R元素位于元素周期表中第ⅡA族
③R元素第一电离能大于同周期相邻元素
④R元素基态原子的电子排布式为1s22s2.
| I1 | I2 | I3 | I4 | … | |
| R | 740 | 1 500 | 7 700 | 10 500 |
②R元素位于元素周期表中第ⅡA族
③R元素第一电离能大于同周期相邻元素
④R元素基态原子的电子排布式为1s22s2.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
20.针对下面几种元素,完成以下各小题.
(1)C、N、O、Si四种元素电负性从小到大排列?硅<碳<氮<氧(填名称).
(2)Na、Mg、Al三种元素第一电离能从大到小排列?Mg>Al>Na(填符号).
(3)Al的电子排布式为?1s22s22p63s23p1?.N的外围电子排布式?2s22p3.
(4)S和O的氢化物相比,沸点较高的是?H2O?(填化学式),原因是?水分子之间存在氢键.
(5)干冰的电子式为? ,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.
,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.
(6)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出其逆反应的热化学方程式:?2NH3(g)?N2(g)+3H2(g)△H=+92kJ•mol-1.(其中N≡N键、N-H键、H-H的键能分别为946kJ•mol-1、391kJ•mol-1、436kJ•mol-1)
(7)26号元素的外围电子排布式为?3d64s2,其+3价阳离子的外围电子的轨道表示式为? .
.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)Na、Mg、Al三种元素第一电离能从大到小排列?Mg>Al>Na(填符号).
(3)Al的电子排布式为?1s22s22p63s23p1?.N的外围电子排布式?2s22p3.
(4)S和O的氢化物相比,沸点较高的是?H2O?(填化学式),原因是?水分子之间存在氢键.
(5)干冰的电子式为?
 ,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.
,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.(6)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出其逆反应的热化学方程式:?2NH3(g)?N2(g)+3H2(g)△H=+92kJ•mol-1.(其中N≡N键、N-H键、H-H的键能分别为946kJ•mol-1、391kJ•mol-1、436kJ•mol-1)
(7)26号元素的外围电子排布式为?3d64s2,其+3价阳离子的外围电子的轨道表示式为?
 .
.
10.下列叙述中正确的是( )
| A. | 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 | |
| B. | 化合反应和置换反应均为氧化还原反应 | |
| C. | 能够电离出H+的物质一定是酸 | |
| D. | 有单质参加或生成的反应一定是氧化还原反应 |
17.下列各主族元素的氢化物的沸点变化规律依次升高的是( )
| A. | HF、HCl、HBr、HI | B. | H2O、H2S、H2Se、H2Te | ||
| C. | NH3、PH3、AsH3、SbH3 | D. | CH4、SiH4、GeH4、SnH4 |
15.下列反应的离子方程式正确的是( )
| A. | 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 苯酚钠溶液中通入少量的CO2:2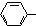 O-+CO2+H2O→2 O-+CO2+H2O→2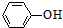 +CO32- +CO32- | |
| C. | 乙醛与新制的氢氧化铜悬浊液:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O | |
| D. | 氯乙酸与足量氢氧化钠溶液共热:ClCH2COOH+OH- $\stackrel{△}{→}$ ClCH2COO-+H2O |
 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题: