题目内容
5.过量铁粉与稀硝酸反应方程式为:3Fe+8HNO3(稀)═3Fe(NO3)2+2NO↑+4H2O,(1)该反应的氧化剂是HNO3,氧化产物是Fe(NO3)2;
(2)标准状况下,当生成2.24L NO气体时,有8.4g Fe参加反应.
分析 (1)氧化还原反应中,化合价升高的物质作还原剂,还原剂发生氧化反应,生成的产物为氧化产物,化合价降低的物质作氧化剂,氧化剂发生还原反应,生成的产物为还原产物;
(2)根据3Fe+8HNO3(稀)═3Fe(NO3)2+2NO↑+4H2O可知:每生成2molNO,所参加反应HFe的物质的量为3mol,据此计算.
解答 解:(1)该反应中元素的化合价变化如下:3Fe→3Fe(NO3)2,Fe元素的化合价由0价→+2价,Fe失去6e-; 2HNO3→2NO,N元素的化合价由+5价→+2价,得到6e-,化合价降低的物质作氧化剂,所以该反应的氧化剂是硝酸,化合价升高的物质作还原剂,铁为还原剂,还原剂发生氧化反应,生成的产物为氧化产物,氧化产物为Fe(NO3)2,
故答案为:HNO3;Fe(NO3)2;
(2)3Fe+8HNO3(稀)═3Fe(NO3)2+2NO↑+4H2O
3mol 2mol
n(Fe) $\frac{2.24L}{22.4L/mol}$
n(Fe)=0.15mol,m(Fe)=n×M=0.15mol×56g/mol=8.4g,
故答案为:8.4.
点评 本题考查了氧化还原反应,明确元素的化合价和氧化还原反应的相关概念是解本题的关键,该题解答氧化剂被还原时须注意硝酸中的氮部分被还原,题目难度不大.

练习册系列答案
相关题目
16.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法中,正确的是( )
| A. | X、M两种元素只能形成X2M型化合物 | |
| B. | 由于Z、M元素的氢化物的稳定性为:Z元素的氢化物大于M元素的氢化物 | |
| C. | 元素Y、Z、W的单质晶体属于同种类型的晶体 | |
| D. | 元素W单质可作为水处理中的消毒剂 |
13.下列物质中存在离子键的是( )
| A. | 金刚石 | B. | 干冰 | C. | 氯化钠 | D. | 铁 |
20.下列表达正确的是( )
| A. | HClO的电子式为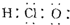 | |
| B. | H2S的电子式可表示为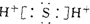 | |
| C. | 用电子式表示Na2O的形成过程为2Nax+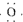 →2Na+ →2Na+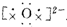 | |
| D. | MgCl2的电子式为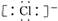 Mg2+ Mg2+ |
10.下列关于来自石油和煤的两种基本化工原料的说法正确的是①乙烯是生产聚乙烯塑料、聚氯乙烯塑料、涤纶等材料的原料②乙烯的产量是衡量一个国家的石油化工发展水平的标志③为了延长果实或花朵的成熟期用浸泡过高锰酸钾溶液的硅藻土处理④从石油中获得乙烯是目前生产乙烯的主要途径,苯从石油或煤焦油中可以获得⑤苯的熔点低,用冰水冷却可凝结成无色晶体 ⑥苯是工业合成染料、消毒剂、锦纶、聚苯乙烯塑料等物质的原料( )
| A. | ①②③④⑥ | B. | ①②④⑤⑥ | C. | ②③④⑤⑥ | D. | 全部 |
17.将下列各组物质按单质、酸、碱、盐分类顺序排列,其中正确的是( )
| A. | 水银、硫酸、烧碱、硫酸氢钠 | B. | 氯水、盐酸、火碱、硫酸钡 | ||
| C. | 臭氧、硝酸、纯碱、胆矾 | D. | 铜、醋酸、石灰石、氯化铜 |
15.下列行为中符合安全要求的是( )
| A. | 节假日期间,在开阔的广场燃放烟花爆竹 | |
| B. | 进入煤矿井时,用火把照明 | |
| C. | 实验时,将水倒入浓硫酸配制稀硫酸 | |
| D. | 用点燃的火柴在液化气钢瓶口检验是否漏气 |