题目内容
【题目】某温度下,浓度都是1 mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得各物质的浓度分别为c(X2)=0.4 mol/L,c(Y2)=0.6 mol/L,c(Z2)=0.4 mol/L,则该反应的化学方程式可表示为
A.2X2+3Y2![]() 2X2Y3B.3X2+2Y2
2X2Y3B.3X2+2Y2![]() 2X3Y2
2X3Y2
C.X2+2Y2![]() 2XY2D.2X2+Y2
2XY2D.2X2+Y2![]() 2X2Y
2X2Y
【答案】B
【解析】
根据浓度的变化计算反应速率,再利用反应速率之比等于化学计量数之比来确定反应式。X2、Y2浓度都是1mol/L,达到平衡时c(X2)=0.4 mol/L,c(Y2)=0.6 mol/L,c(Z2)=0.4 mol/L,则X2、Y2、Z的反应速率之比为![]() :
:![]() :
:![]() =3:2:2。根据反应速率之比等于化学计量数之比可知,该反应式为3X2+2Y2
=3:2:2。根据反应速率之比等于化学计量数之比可知,该反应式为3X2+2Y2![]() 2X3Y2。
2X3Y2。
答案选B。

【题目】苯胺(又名氨基苯)是最重要的胺类物质之一,可作为炸药中的稳定剂、汽油中的防爆剂,也可作为医药磺胺药的原料等。苯胺为无色油状液体,有特殊气味,可用水蒸气蒸馏提纯。用纳米铁粉还原硝基苯制备苯胺的原理及装置图(略去夹持装置和加热装置)如下:
4![]() +9Fe+4H2O
+9Fe+4H2O![]() 4
4![]() +3Fe3O4
+3Fe3O4
已知部分有机物的一些数据如下表:
名称 | 密度(gmL-1) | 熔点(℃) | 沸点(℃) | 溶解性 | 备注 |
硝基苯 | 1.2037 | 5.7 | 210.8 | 难溶于水,易溶于乙醇、乙醚 | |
苯胺 | 1.0217 | -6.3 | 184.4 | 难溶于水,易溶于乙醇、乙醚 | 空气中易变质 |
乙醚 | 0.7134 | -116.3 | 34.6 | 微溶于水,易溶于乙醇 |
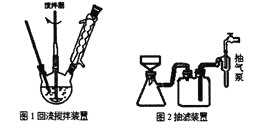
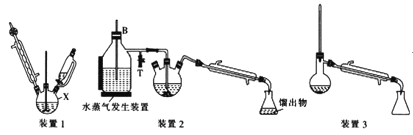
Ⅰ.合成:在装置1中的仪器X中,加入9g纳米铁粉、20mL水、1mL冰醋酸,加热至煮沸,煮沸3~5min后冷却至室温,再将7.0mL硝基苯逐滴加入(该反应强烈放热),搅拌、加热、回流半小时,至反应完全。
Ⅱ.分离提纯:将装置1改为装置2进行水蒸气蒸馏,取装置2中的馏出物约5~6mL,转移至分液漏斗中,分离出有机层后,水层加入1.3gNaCl固体,用乙醚萃取3次(每次用7.0mL乙醚),合并有机层和乙醚萃取液,加入粒状NaOH干燥,过滤后转移至干燥的圆底烧瓶中,水浴蒸去乙醚,残留物再利用装置3蒸馏并收集温度T℃时的馏分。
请回答下列问题:
(1)由苯制取硝基苯的化学方程式为__。
(2)仪器X的名称是__;加入硝基苯时,“逐滴加入span>”的目的是__。
(3)分离提纯过程中加入NaCl固体的作用是__。
(4)装置2和装置3都需要通冷凝水,冷凝水的作用是__;装置2中长导管B的作用是__。
(5)萃取分液操作过程中要远离明火和热源,原因是__。
(6)温度T的范围为__,实验结束得到6.0mL产物,则苯胺的产率为__(保留三位有效数字)。