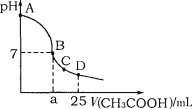
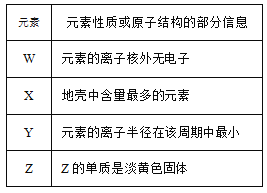
题目内容
【题目】向容积为2L的密闭容器中充入一定量的H2O和CO,维持700℃发生反应:CO(g) + H2O(g)![]() CO2(g) + H2(g),反应过程中测定的部分数据见下表(表中t1<t2):
CO2(g) + H2(g),反应过程中测定的部分数据见下表(表中t1<t2):
反应时间/min | n(CO)/mol | H2O/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B. 其他条件不变,起始时容器中充入0.60molCO和1.20 molH2O,达平衡时,n(CO2)=0.40 mol
C. 保持其他条件不变,向平衡体系中再通入0.20 molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D. 若温度升至800℃,上述反应的平衡常数为0.64,则正反应为吸热反应
【答案】B
【解析】试题分析:A.v(CO)=![]() mol/(Lmin),化学反应速率之比等于化学计量数之比,则v(H2)=v(CO)=
mol/(Lmin),化学反应速率之比等于化学计量数之比,则v(H2)=v(CO)=![]() mol/(Lmin),故A错误;B.CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O,平衡时生成物的浓度对应相同,t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,根据化学方程式可知,则生成的n(CO2)=0.4mol,故B正确;C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大,故C错误;
mol/(Lmin),故A错误;B.CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O,平衡时生成物的浓度对应相同,t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,根据化学方程式可知,则生成的n(CO2)=0.4mol,故B正确;C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大,故C错误;
D.t1min时反应已经达到平衡状态,此时c(CO)=0.8mol/2L=0.4mol/L,c(H2O)=0.2mol/2L=0.1mol/L,c(CO2)=c(H2)=0.4mol/2L=0.2mol/L,则k=![]() =1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动的,那么正反应应为放热反应,故D错误;故选B。
=1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动的,那么正反应应为放热反应,故D错误;故选B。

 阅读快车系列答案
阅读快车系列答案【题目】硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,可以通过出现浑浊的快慢来判断反应的快慢程度,下列各组实验中最先出现浑浊的是( )
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | ||
V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | ||
A | 25 | 5 | 0.1 | 20 | 0.1 |
B | 25 | 5 | 0.2 | 10 | 0.2 |
C | 35 | 5 | 0.1 | 20 | 0.1 |
D | 35 | 5 | 0.2 | 10 | 0.2 |
A. A B. B C. C D. D
【题目】工业上用矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)获取铜和胆矾的操作流程如下:

已知:①部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
②B、C均为单一沉淀
请回答下列问题:
(1)已知Cu2O在酸性条件下发生自身氧化还原反应,写出离子反应方程式______________。
(2)为了加快反应I的速率,可以采取的措施是______________(写1点)。
(3)固体混合物A中的成分是__________________________。
(4)反应I完成后,铁元素的存在形式为_______________(填离子符号);写出生成该离子的离子方程式___________________________________。
(5)x对应的数值范围是_______________________。用NaClO调pH,生成沉淀B的反应的离子方程式为____________________________________。
(6)已知:Ksp[Al(OH)3]=1.1×10-33,当调节溶液的pH为5时,c(Al3+)=_________ molL-1
(7)洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤.原因是___________________。