题目内容
18.(1)用单线桥法表示在反应Zn+2HCl═ZnCl2+H2↑中的电子转移情况(2)在反应4HCl(浓)+MnO2=MnCl2+Cl2↑+2H2O中,氧化剂是MnO2,当有4mol HCl参加反应时转移的电子的物质的量为2 mol.
(3)在反应:3C+2KNO3+S═K2S+N2↑+3CO2↑中,2mol KNO3可氧化的C的物质的量为2.5mol.
分析 (1)在Zn+2HCl(稀)=ZnCl2+H2↑反应中,Zn元素化合价升高2,为还原剂,H元素化合价降低1,HCl为氧化剂,1mol锌参加反应失去2mol电子;
(2)依据化合价变化判断氧化剂、还原剂及电子转移数目;
(3)反应2KNO3+3C+S=K2S+N2↑+3CO2↑中,N、S元素的化合价降低,C元素的化合价升高,含元素化合价降低的物质为氧化剂,氧化剂被还原,而含元素化合价升高的物质为还原剂,依据氧化剂与还原剂得失电子数守恒计算2mol KNO3可氧化的C的物质的量.
解答 解:(1)在Zn+2HCl(稀)=ZnCl2+H2↑反应中,Zn元素化合价升高2,为还原剂,H元素化合价降低1,HCl为氧化剂,1mol锌参加反应失去2mol电子,用单线桥表示为: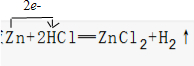 ;
;
故答案为: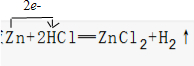 ;
;
(2)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,则MnO2为氧化剂,Cl元素的化合价升高,则HCl为还原剂,依据方程式可知:美生成1mol氯气,有2mol氯化氢中氯原子被氧化,转移2mol电子;
故答案为:MnO2,2;
(3).在反应2KNO3+3C+S=K2S+N2↑+3CO2↑中,N元素的化合价由+5降低为0,S元素的化合价由0降低为-2价,则KNO3和S作氧化剂,C由0价升高为+4价,做还原剂,2mol KNO3得到电子数为2mol×5=10mol,设能够氧化碳的物质的量为xmol,则依据得失电子守恒得:10mol=x×4,解得x=2,5;
故答案为:2.5.
点评 本题考查了氧化还原反应的分析及有关计算,熟悉相关概念及氧化还原反应得失电子守恒规律即可解答,题目难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
6.已知氧化性:Cl2>Br2>Fe3+;还原性:Fe2+>Br->Cl-.向FeBr2溶液中通入Cl2至过量,因Cl2的量不同溶液中的反应情况不同,其中错误的是( )
| A. | 2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 2Br-+Cl2═Br2+2Cl- | |
| C. | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
3.下列说法正确的是( )
| A. | 化合反应都是氧化还原反应 | |
| B. | 复分解反应都不是氧化还原反应 | |
| C. | 在反应 2H2S+SO2=3S+2H2O中,还原剂是SO2 | |
| D. | 在一个氧化还原反应中,同一种反应物不可能既是氧化剂又是还原剂 |
10.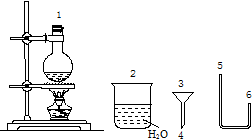 某化学小组在实验室用下图提供的仪器制备溴乙烷.
某化学小组在实验室用下图提供的仪器制备溴乙烷.
已知:
①反应原理:NaBr+H2SO4(较浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr
HBr+C2H5OH$\frac{\underline{\;\;△\;\;}}{\;}$C2H5Br+H2O
②反应物用量:NaBr(S)25g,无水乙醇15mL,浓H2SO430mL,水15mL
③溴乙烷和乙醇的部分物理性质如下表
回答下列问题:
(1)连接上述仪器的顺序是:1接6接5接( 4 )接( 3 )接2(填数字).你认为反应后溴乙烷在烧杯(填“烧瓶”或“烧杯”)中
(2)由于浓硫酸具有强氧化性,反应产生副产物,使粗制溴乙烷常呈黄色,该副产物是Br2(写化学式),除去该杂质的试剂和方法是NaOH溶液,分液取下层,为了减少该副产物的生成,本实验采取了反应物中加入水,稀释浓硫酸,降低其氧化性,减少副产品溴的生成的措施.
 某化学小组在实验室用下图提供的仪器制备溴乙烷.
某化学小组在实验室用下图提供的仪器制备溴乙烷.已知:
①反应原理:NaBr+H2SO4(较浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr
HBr+C2H5OH$\frac{\underline{\;\;△\;\;}}{\;}$C2H5Br+H2O
②反应物用量:NaBr(S)25g,无水乙醇15mL,浓H2SO430mL,水15mL
③溴乙烷和乙醇的部分物理性质如下表
| 密度/g•mL-1 | 沸点/℃ | 溶解性 | |
| 溴乙烷 | 1.461 | 38 | 难溶于水 |
| 乙醇 | 0.789 | 78 | 易溶于水 |
(1)连接上述仪器的顺序是:1接6接5接( 4 )接( 3 )接2(填数字).你认为反应后溴乙烷在烧杯(填“烧瓶”或“烧杯”)中
(2)由于浓硫酸具有强氧化性,反应产生副产物,使粗制溴乙烷常呈黄色,该副产物是Br2(写化学式),除去该杂质的试剂和方法是NaOH溶液,分液取下层,为了减少该副产物的生成,本实验采取了反应物中加入水,稀释浓硫酸,降低其氧化性,减少副产品溴的生成的措施.
3.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体 | |
| B. | 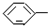 CH=CH 2是苯的同系物 CH=CH 2是苯的同系物 | |
| C. | 苯、油均不能使酸性KMnO4溶液褪色 | |
| D. | 人体中没有水解纤维素的酶,所以纤维素在人体中没有任何作用 |
4.在一定温度下某容积固定的密闭容器中,建立下列化学平衡:C(s)+H2O(g)?CO(g)+H2(g),不能确定上述可逆反应在一定条件下已达到化学平衡状态的是( )
| A. | 体系的压强不再发生变化 | |
| B. | v正(CO)=v逆(H2O) | |
| C. | 生成nmolCO的同时生成nmolH2 | |
| D. | 1molH-H键断裂的同时断裂2molH-O键 |