题目内容
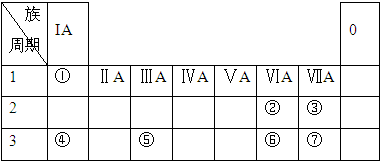
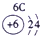
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
(1)⑥的最低负价是
(2)③、④、⑦的简单离子半径由大到小的顺序为
(3)②、④两种元素的原子按1:1组成的常见化合物的电子式为
 .
.
(4)②、⑥的单质中更易与①的单质反应的是
(5)④、⑤的最高价氧化物的水化物之间发生反应的离子方程式:

(1)⑥的最低负价是
-2
-2
;⑦的最高价含氧酸的化学式为HClO4
HClO4
.(2)③、④、⑦的简单离子半径由大到小的顺序为
Cl->F->Na+
Cl->F->Na+
.(3)②、④两种元素的原子按1:1组成的常见化合物的电子式为


(4)②、⑥的单质中更易与①的单质反应的是
O2
O2
,原因是氧气的氧化性强于硫单质
氧气的氧化性强于硫单质
.(5)④、⑤的最高价氧化物的水化物之间发生反应的离子方程式:
Al(OH)3+OH-=[Al(OH)4]-
Al(OH)3+OH-=[Al(OH)4]-
.分析:根据元素所在周期表中的位置,可知元素的种类,①为H元素,②为O元素,③为F元素,④为Na元素,⑤为Al元素,⑥为S元素,⑦为Cl元素,
(1)元素的最低负价=-(8-最外层电子数),最高正价=最外层电子数;
(2)电子层越多半径越大,电子层数一样的,质子数越小,半径越大;
(3)根据组成元素以及个数比来书写化学式;
(4)同主族从上到下单质的氧化性减弱;
(5)根据氢氧化铝可以和强碱之间反应来书写.
(1)元素的最低负价=-(8-最外层电子数),最高正价=最外层电子数;
(2)电子层越多半径越大,电子层数一样的,质子数越小,半径越大;
(3)根据组成元素以及个数比来书写化学式;
(4)同主族从上到下单质的氧化性减弱;
(5)根据氢氧化铝可以和强碱之间反应来书写.
解答:解:根据元素所在周期表中的位置,可知元素的种类,①为H元素,②为O元素,③为F元素,④为Na元素,⑤为Al元素,⑥为S元素,⑦为Cl元素,
(1)S的最低负价是-2,Cl的最高价含氧酸的化学式为HClO4,故答案为:-2;HClO4;
(2)F-、Na+、Cl-的电子层数依次是2,2,3,所以半径最大的是Cl-,钠离子核内质子数是11,氟离子核内质子数是9,所以氟离子半径大于钠离子,即离子半径由大到小的顺序为
Cl->F->Na+,故答案为:Cl->F->Na+;
(3)Na、O两种元素的原子按1:1组成的常见化合物过氧化钠的电子式为 ,故答案为:
,故答案为: ;
;
(4)氧气的氧化性强于硫单质,氧气更易和氢气反应,故答案为:O2;氧气的氧化性强于硫单质;
(5)氢氧化铝和氢氧化钠反应的实质是Al(OH)3+OH-=[Al(OH)4]-,故答案为:Al(OH)3+OH-=[Al(OH)4]-.
(1)S的最低负价是-2,Cl的最高价含氧酸的化学式为HClO4,故答案为:-2;HClO4;
(2)F-、Na+、Cl-的电子层数依次是2,2,3,所以半径最大的是Cl-,钠离子核内质子数是11,氟离子核内质子数是9,所以氟离子半径大于钠离子,即离子半径由大到小的顺序为
Cl->F->Na+,故答案为:Cl->F->Na+;
(3)Na、O两种元素的原子按1:1组成的常见化合物过氧化钠的电子式为
 ,故答案为:
,故答案为: ;
;(4)氧气的氧化性强于硫单质,氧气更易和氢气反应,故答案为:O2;氧气的氧化性强于硫单质;
(5)氢氧化铝和氢氧化钠反应的实质是Al(OH)3+OH-=[Al(OH)4]-,故答案为:Al(OH)3+OH-=[Al(OH)4]-.
点评:本题考查元素的推断,题目难度不大,根据元素在周期表中的物质可推断出元素的种类,题中侧重于周期律的应用,学习中注意积累相关知识.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目









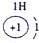
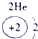
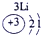
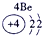
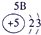
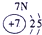
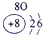
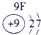
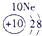
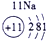





 表示的是
表示的是