题目内容
有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为 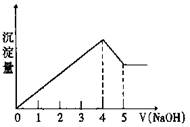
| A.2∶1 | B.4∶1 | C.1∶1 | D.1∶2 |
D
解析试题分析:本题当从题意可得,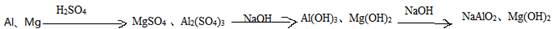
结合坐标图分析,沉淀溶解部分消耗了VL浓度为Cmol/L的NaOH,由方程式Al(OH)3+OH-=AlO2-+2H2O,再根据原子守恒可知铝的物质的量为CVmol,要求Mg的物质的量,须由消耗的4VLNaOH入手,由前面可知,生成CVmol的Al(OH)3需要消耗3CVmol的NaOH,所以生成Mg(OH)2消耗的NaOH为CVmol,由方程式Mg2++2OH-=Mg(OH)2↓可知,Mg(OH)2的物质的量为0.5CVmol.所以原金属中镁、铝的物质的之比为0.5CVmol:CVmol=1:2。
考点: 镁、铝及其化合物的性质

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案部分氧化的铁铜合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理: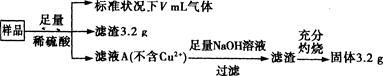
下列说法正确的是 ( )
| A.滤液A中的阳离子为Fe3+、Fe2+、H+ |
| B.V=896 |
| C.样品中CuO的质量为4.0 g |
| D.样品中Fe元素的质量为2.24g |
所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,下表为四种金属的熔、沸点:
| | Na | Cu | Al | Fe |
| 熔点(℃) | 97.5 | 1 083 | 660 | 1 535 |
| 沸点(℃) | 883 | 2 595 | 2 200 | 3 000 |
A.Cu和Na B.Fe和Cu
C.Fe和Al D.Al和Na
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金作载热介质,有关说法不正确的是( )
| A.合金的熔点一般比组分金属低 |
| B.铝钠合金若投入一定量的水中可完全溶解得无色溶液,则n(Al)≤n(Na) |
| C.铝钠合金投入到足量氯化铜溶液中,会有氢氧化铜沉淀也可能有铜析出 |
| D.若m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小 |
下列金属中,通常采用热还原法冶炼的是
| A.Na | B.Al | C.Fe | D.Ag |
固体粉末X中可能含有Fe、Fe2O3、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下: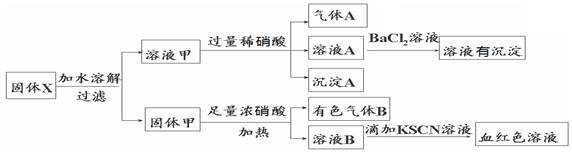
根据上述实验,以下说法正确的是
| A.气体A一定只是NO |
| B.由于在溶液A中加入BaCl2溶液有沉淀产生,因此可以判断溶液中含有K2SO3 |
| C.若向固体甲中加入足量浓盐酸,再加KSCN溶液,没有血红色,则证明原混合物中一定没有Fe2O3 |
| D.溶液甲中一定含有K2SiO3、可能含有KAlO2、MgCl2 |
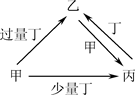
甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是( )
| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | NaOH | NaHSO3 | Na2SO3 | SO2 |
| B | AlCl3 | NaAlO2 | Al(OH)3 | NaOH |
| C | Fe | Fe(NO3)3 | Fe(NO3)2 | HNO3 |
| D | C | CO | CO2 | O2 |
下列物质不能使红墨水褪色的是( )
| A.活性炭 | B.过氧化钠 | C.NaCl溶液 | D.漂白粉 |
甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系。 下列说法正确的是
下列说法正确的是
| A.若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物 |
| B.若甲为金属单质,乙为非金属单质,则甲只能是Mg |
| C.若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si |
| D.若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2 |