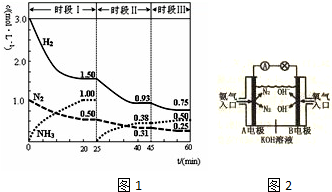
题目内容
2.取含脉石(SiO2)的硫铁矿试样10克,在氧气中充分灼烧,残余固体质量为8克,试样中FeS2的含量为百分之几?取这种矿石500吨,反应过程中硫损失3%,可制得98%硫酸多少吨?分析 依据化学方程式的差量变化计算硫化亚铁的纯度;用含FeS2质量分数为80%的硫铁矿制硫酸,转化过程为FeS2~2SO2~2SO3~2H2SO4,依据硫原子个数守恒找到FeS2与H2SO4的关系进行计算.
解答 解:设硫化亚铁质量为x,4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2 △m
480 160
x 10-8
$\frac{480}{x}=\frac{160}{10-8}$,x=6g
该硫铁矿式样的纯度=$\frac{6g}{10g}$×100%=60%;
用含FeS2质量分数为60%的硫铁矿制硫酸,转化过程为FeS2~2SO2~2SO3~2H2SO4,设制得98%硫酸xt则:
FeS2 ~2SO2 ~2SO3 ~2H2SO4,
120 196
500t×60%×(100-3)% x×98%
$\frac{120}{500×60%×(100-3)%}$=$\frac{196}{x×98%}$
解得:x=485t;
答:试样中FeS2的含量为60%,可制得98%硫酸485吨.
点评 本题考查化学方程式的计算,能够依据原子个数守恒找出硫化亚铁与硫酸之间的关系是解题关键,题目难度中等.

练习册系列答案
相关题目
12.下列各项中表达正确的是( )
| A. | H、D、T表示同一种核素 | |
| B. | F-离子结构示意图: | |
| C. | 用电子式表示HCl形成过程:H${\;}_{\;}^{•}$+${\;}_{\;}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$→H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| D. | 次氯酸电子式:H${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ |
10.设NA代表阿伏伽德罗常数,下列叙述正确的是( )
| A. | 将1molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,若不考虑挥发,溶液中含有的NH4+数目小于NA | |
| B. | 24g石墨烯(单层石墨)中含有六元环的个数为NA | |
| C. | 标准状况下,6.72LNO2与足量水反应转移电子数目为0.2NA | |
| D. | 4.6gC2H6O加入足量的金属钠,充分作用,生成H2分子数一定为0.05NA |
17.已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=a kJ•mol一1
CH3OH(l)=CH4(g)+$\frac{1}{2}$O2(g)△H=b kJ•mol一1
CO2(g)+2H2O(g)=CH3OH(l)+$\frac{3}{2}$O2(g)△H=+638.5 kJ•mol一1
则下列叙述正确的是( )
CH3OH(l)=CH4(g)+$\frac{1}{2}$O2(g)△H=b kJ•mol一1
CO2(g)+2H2O(g)=CH3OH(l)+$\frac{3}{2}$O2(g)△H=+638.5 kJ•mol一1
则下列叙述正确的是( )
| A. | 甲烷的燃烧热为a kJ•mol-1 | B. | a一定大于0 | ||
| C. | a+b=-638.5 | D. | b一定小于0 |
5.下列叙述正确的是( )
| A. | 同主族元素从上到下,元素原子得电子能力逐渐减弱,表现在氢化物的稳定性逐渐增强 | |
| B. | 除稀有气体元素外,第三周期元素的原子半径不一定比第二周期元素的原子半径大 | |
| C. | 化学反应的过程中一定伴随着热量的变化 | |
| D. | 在主族元素中,最外层电子数少的元素原于一定比最外层电子数多的元素原子失电子能力强 |
6.某有机物在O2中充分燃烧生成CO2和H2O的物质的量之比为1:2,由此可得出的结论是( )
| A. | 该有机物分子中C、H、O原子个数比为1:4:1 | |
| B. | 该有机物分子中C、H原子个数比为1:4 | |
| C. | 该有机物中必定含有氧元素 | |
| D. | 该有机物化学式为CH4O |
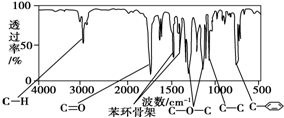 化合物A经李比希法测得其 中含C 72.0%、H 6.67%,其余含有氧;质谱法分析得知A的相对分子质量为150.现代仪器分析有机化合物的分子结构有以下两种方法.
化合物A经李比希法测得其 中含C 72.0%、H 6.67%,其余含有氧;质谱法分析得知A的相对分子质量为150.现代仪器分析有机化合物的分子结构有以下两种方法.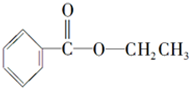 、
、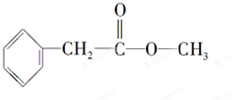 ;
; .
. 铁是人类使用最广泛的金属.
铁是人类使用最广泛的金属.