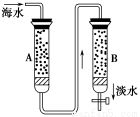
题目内容
海水中镁的总储量约为2.1×1015t,目前世界上60%的镁来自海水,工业规模海水提镁的流程如图所示:
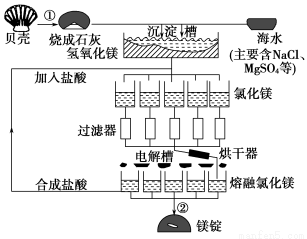
试回答下列问题:
(1)海水提镁的过程中①、②反应的化学方程式:
①_____________________________________,
②______________________________________。
(2)由氯化镁溶液制取无水氯化镁固体,其操作过程是____________________
(3)为了使MgSO4完全转化为Mg(OH)2,则加入的生石灰要过量,然后分离得Mg(OH)2沉淀,考虑Ca(OH)2溶解度,应该用________法分离。
(4)金属镁、铝的工业冶炼方法既有相似之处,又有不同之别,下表是氧化镁和氯化镁的熔沸点数据:
物质 | 氧化镁 | 氯化镁 |
熔点(℃) | 2 852 | 714 |
沸点(℃) | 3 600 | 1 412 |
工业上炼镁采用电解熔融氯化镁,而冶炼铝则用电解熔融的Al2O3,其原因是____________________________________
(1)①CaCO3 CaO+CO2↑
CaO+CO2↑
②MgCl2(熔融)  Mg+Cl2↑
Mg+Cl2↑
(2)先加热蒸发、冷却结晶得到MgCl2·6H2O,然后在HCl气氛中加热得到无水MgCl2
(3)低温过滤
(4)MgCl2的熔点较MgO的熔点低,熔融MgCl2消耗较少的能量,节约能源,降低成本;AlCl3是共价化合物,熔融不导电,只能电解熔融(熔于冰晶石中)Al2O3生产铝
【解析】(1)贝壳的主要成分是CaCO3,高温CaCO3分解生成CaO和CO2,CaO与H2O生成的Ca(OH)2又与Mg2+生成Mg(OH)2,Mg(OH)2加HCl在一定条件下生成无水MgCl2,电解MgCl2(熔融)在阴、阳极上分别得Mg和Cl2。
(2)对MgCl2溶液加热蒸发得到MgCl2·6H2O,由于MgCl2·6H2O在受热条件下易水解,为防止水解应在HCl气氛中加热脱水转化为无水MgCl2。
(3)因为Ca(OH)2的溶解度是随温度升高而降低,为了减少Ca(OH)2与Mg(OH)2共沉,所以在低温下过滤,所得Mg(OH)2纯度较高。
(4)AlCl3是共价化合物,熔化后不导电,故可电解熔化的Al2O3得铝单质;而从表可看出MgO的熔点较MgCl2高,虽然电解两种物质均可得到单质镁,但熔化MgO比MgCl2消耗更多的能量,从经济角度考虑,一般多用电解熔融MgCl2法制Mg。