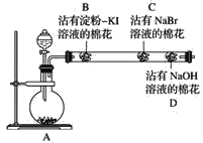
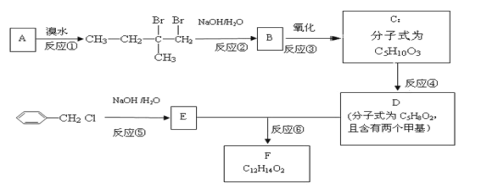
题目内容
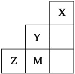
【题目】下表为长式周期表的一部分其中的编号代表对应的元素.
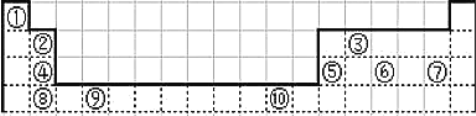
请回答下列问题:
(1)表中属于 ds 区的元素是___________(填元素符号)它的基态原子的价电子排布式为___________。
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为____________,其中元素③的基态原子轨道表达式为___________;①和⑥形成的一种常见四原子分子的化学式为___________,它是 _________________(填“极性”、“非极性”)分子。
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为___________;该元素与元素①形成的最简单分子 X 的电子式为___________。
(4)元素⑤的电负性___________④元素的电负性(选填>、=、<下同);元素⑥的第一电离能___________原子序数为 16 的元素的第一电离能。
(5)用电子式表示元素④和⑦组成的化合物的形成过程________________________。
(6)上表中元素⑤的氢氧化物为两性氢氧化物,请写出元素⑤的氢氧化物与NaOH溶液反应的化学方程式:_______________________________。
【答案】Cu 3d104s1 C6H6 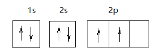 PH3 极性 3
PH3 极性 3 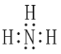 > >
> > ![]() Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3+NaOH=NaAlO2+2H2O
【解析】
根据元素周期表中元素的分布可知,①为H元素,②为Be元素,③为C元素,④为Mg元素,⑤为Al元素,⑥为P元素,⑦为Cl元素,⑧为Ca元素,⑨为Ti元素,⑩为Cu元素。
(1)表中属于 ds 区的元素是Cu元素,为29号元素,其基态原子的价电子排布式为:3d104s1,故答案为:Cu;3d104s1;
(2)①为H元素,③为C元素,6个H原子与6个C原子形成的平面环状分子为苯,其分子式为C6H6,C元素为6号元素,其基态原子轨道表达式为![]() ;⑥为P元素,H元素和P元素形成的一种常见四原子分子的化学式为PH3,它是极性分子,故答案为:C6H6;
;⑥为P元素,H元素和P元素形成的一种常见四原子分子的化学式为PH3,它是极性分子,故答案为:C6H6;![]() ;PH3;极性;
;PH3;极性;
(3)某元素原子的价电子排布式为 nsnnpn+1,n为2,所以价电子排布式为2s22p3,该元素为N元素,其原子的电子层上未成对电子数为3;与H元素形成的最简单分子为NH3,其电子式为: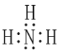 ,故答案为:3;
,故答案为:3;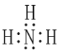 ;
;
(4)④为Mg元素,⑤为Al元素,同周期,从左到右,电负性增强,电负性:Al>Mg;⑥为P元素,原子序数为16的元素为S元素,P元素的价电子排布式为:3s23p3、半满状态,较稳定,第一电离能:P>S,故答案为:>;>;
(5)④为Mg元素,⑦为Cl元素,可以形成MgCl2,是离子化合物,形成过程:![]() ,故答案为:
,故答案为:![]() ;
;
(6)⑤为Al元素,其氢氧化物为氢氧化铝,与NaOH溶液反应生成偏铝酸钠和水,其化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:Al(OH)3+NaOH=NaAlO2+2H2O。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案