题目内容
【题目】直接排放SO2、NO2会危害环境。工业上常采用化学方法控制污染。
(1)下图是1mol CH4完全燃烧生成气态水的能量变化和1molS(g)燃烧的能量变化。

①CH4完全燃烧的活化能是_____________kJ/mol
②在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式_____________________________;
(2)为减少SO2排放,将含SO2的烟气通过洗涤剂X,充分吸收后再向吸收后的溶液中加入稀硫酸,既可以回收![]() ,同时又可得到化肥。X可以是__________(填序号)。
,同时又可得到化肥。X可以是__________(填序号)。
a.Ca(OH)2 b.K2CO3 c.Na2SO3 d.NH3H2O
(3)对NO2+SO2![]() SO3+NO △H<0反应进行探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率。实验结果如图所示:
SO3+NO △H<0反应进行探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率。实验结果如图所示:

①能够加快该化学反应速率的外界条件是___________________
a.降低温度 b.增大压强 c.升高温度 d.减小压强
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是___________;
③若A点对应实验中,SO2(g)的起始浓度为c0mol/L,经过![]() min达到平衡状态,该时段化学反应速率v(NO2)___mol/(Lmin);
min达到平衡状态,该时段化学反应速率v(NO2)___mol/(Lmin);
④图中C、D两点对应的实验温度分别为![]() 和
和![]() ,计算判断
,计算判断![]() ______
______![]() (填>、=、或<)
(填>、=、或<)
【答案】126kJ/mol CH4(g)+2SO2(g)=2S(g)+2H2O(g)+CO2(g) △H=+352kJ/mol bd bc 降低温度 ![]() =
=
【解析】
(1)①活化能是物质发生化学反应需要的最低能量;
②先根据图示写出两个反应的热化学方程式,然后将二者叠加,可得该反应的热化学方程式;
(2)分别加入不同的洗涤剂X,根据不同的洗涤剂X与SO2发生的不同反应,判断符合条件的洗涤剂X;
(3)①根据影响化学反应速率的因素分析判断;
②如果要将图中C点的平衡状态改变为B点的平衡状态,即在不改变物料比的情况下,增加NO2的平衡转化率,考虑温度和压强对化学平衡的影响;
③A点实验中,NO2的平衡转化率α(NO2)=50%,起始时,SO2(g)的起始浓度为c0mol/L,起始时的物料比为![]() =0.4,可计算起始时NO2的量,根据化学反应平均速率计算公式v(NO2)=
=0.4,可计算起始时NO2的量,根据化学反应平均速率计算公式v(NO2)=![]() 计算;
计算;
④C、D两点对应的实验温度分别为TC和TD,温度和平衡常数有关,结合图中的数据,分别计算C和D点时的化学平衡常数,据此判断两点温度。
(1)①活化能是物质发生化学反应需要的最低能量,根据图示可知甲烷的活化能为126kJ/mol;
②根据图示可得热化学方程式:i:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-902kJ/mol;
ii:S(g)+O2(g)=SO2(g) △H=-577kJ/mol,则根据盖斯定律,i-2×ii,整理可得CH4(g)+ SO2(g)= 2S(g)+2H2O(g)+CO2(g) △H=+352kJ/mol;
(2)分别加入不同的洗涤剂X,根据不同的洗涤剂X与SO2发生的不同反应,要求将含SO2的烟气通过洗涤剂X,充分吸收后再向吸收后的溶液中加入稀硫酸,既可以回收SO2,同时又可得到化肥,植物需求量较大的化肥是氮肥,磷肥,钾肥,
a.若洗涤剂X选用Ca(OH)2,通入SO2反应产生CaSO3,加入稀硫酸反应可以回收SO2,同时产生CaSO4,但不是化肥,a不符合题意;
b.若洗涤剂X选用K2CO3,溶液碱性较强,可以吸收SO2,加入稀硫酸反应可以回收SO2,同时产生钾肥,b符合题意;
c.若洗涤剂X选用Na2SO3,溶液碱性较强,可发生反应生成NaHSO3,加入稀硫酸反应可以回收SO2,同时产生Na2SO4,但不是化肥,c不符合题意;
d.若洗涤剂X选用NH3H2O,是碱性溶液,可以吸收SO2,加入稀硫酸反应可以回收SO2,同时产生(NH4)2SO4,(NH4)2SO4是氮肥,d符合题意;
故合理选项是bd;
(3)①a.降低温度,物质的内能降低,活化分子数目减小,有效碰撞次数增加,反应速率降低,a错误;
b.增大压强,物质的浓度增大,单位体积内的活化分子数增加,反应速率加快,b正确;
c.升高温度物质的内能增加,活化分子数目增多,活化分子数目增加,有效碰撞次数增加,反应速率加快,c正确;
d.减小压强,物质的浓度降低,单位体积内的活化分子数减少,有效碰撞次数减少,化学反应速率降低,d错误;
故合理选项是bc;
②如果要将图中C点的平衡状态改变为B点的平衡状态,即在不改变物料比的情况下,增加NO2的平衡转化率,反应为:NO2(g)+SO2(g)![]() SO3(g)+NO(g),△H<0,该反应的正反应为反应前后气体体积不变的放热反应,压强变化对化学平衡不产生影响,要增加NO2的平衡转化率,使化学平衡向正反应方向移动,可采取降低温度的方式;
SO3(g)+NO(g),△H<0,该反应的正反应为反应前后气体体积不变的放热反应,压强变化对化学平衡不产生影响,要增加NO2的平衡转化率,使化学平衡向正反应方向移动,可采取降低温度的方式;
③A点实验中,NO2的平衡转化率α(NO2)=50%,起始时,SO2(g)的起始浓度为c0mol/L,起始时的物料比为![]() =0.4,则起始时,NO2的物质的量浓度为c(NO2)=c0mol/L×0.5=0.4c0mol/L,NO2的平衡转化率α(NO2)=50%,则NO2转化了△c=0.4c0×50%=0.2c0mol/L,反应经历的时间为△t=tmin,则该时段化学反应速率v(NO2)=
=0.4,则起始时,NO2的物质的量浓度为c(NO2)=c0mol/L×0.5=0.4c0mol/L,NO2的平衡转化率α(NO2)=50%,则NO2转化了△c=0.4c0×50%=0.2c0mol/L,反应经历的时间为△t=tmin,则该时段化学反应速率v(NO2)=![]() =
=![]() =
=![]() mol/(L
mol/(L![]() min);
min);
④C、D两点对应的实验温度分别为TC和TD,温度和平衡常数有关,结合图中的数据,反应为:NO2(g)+SO2(g)![]() SO3(g)+NO(g),△H<0
SO3(g)+NO(g),△H<0
C点时,起始物料比为![]() =1.0,NO2的平衡转化率为α(NO2)=50%,设起始时c(NO2)=50%=c(SO2)=xmol/L,化学平衡常数为K(C)=
=1.0,NO2的平衡转化率为α(NO2)=50%,设起始时c(NO2)=50%=c(SO2)=xmol/L,化学平衡常数为K(C)=![]() =
=![]() =1;
=1;
D点时,起始物料比为![]() =1.5,,NO2的平衡转化率为α(NO2)=40%,设起始时c(SO2)=ymol/L,c(NO2)=1.5ymol/L,化学平衡常数为K(D)=
=1.5,,NO2的平衡转化率为α(NO2)=40%,设起始时c(SO2)=ymol/L,c(NO2)=1.5ymol/L,化学平衡常数为K(D)=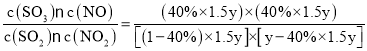 =1,K(C)= K(D),化学平衡没有发生移动,因此TC=TD。
=1,K(C)= K(D),化学平衡没有发生移动,因此TC=TD。

 阅读快车系列答案
阅读快车系列答案【题目】用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为_____________mol·L-1.
(2)达到滴定终点的标志是_______________________________________________________
(3)以下操作造成测定结果偏高的原因可能是__________________。
A. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 未用标准液润洗碱式滴定管