题目内容
【题目】I. CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如下表:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
(1)推导反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_________,判断该反应是_____________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_________,判断该反应是_____________反应(填“吸热”或“放热”)。
II. T1温度下,体积为2L的恒容密闭容器,加入4.00molX,2.00molY,发生化学反应 2X(g)+Y(g) ![]() 3M(g)+N(s) △H<0。
3M(g)+N(s) △H<0。
部分实验数据如下:
t/s | 0 | 500 | 1000 | 1500 |
n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
(2)当反应达到平衡后,其他条件不变,分离出部分M,则新平衡时,正反应速率相对于原平衡____________(填“增大”、“减小”、或“不变”)。
(3)该反应达到平衡时某物理量随温度变化如下图所示。纵坐标可以表示的物理量有哪些____。

a.Y的逆反应速率
b.M的体积分数
c.混合气体的密度
d.X的转化率
(4)反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是_____________。
A.重新达平衡后,用X表示的υ(正)比原平衡大
B.重新达平衡后,M的体积分数小于50%
C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍
D.重新达平衡后,Y的平均反应速率与原平衡相等
(5)若容器为绝热恒容容器,起始时加入4.00molX,2.00molY,则达平衡后M的物质的量浓度____________1.5mol/L(填“大于”、“小于”或“等于”)。
【答案】![]() 吸热 减小 b d AC 小于
吸热 减小 b d AC 小于
【解析】
(1)①Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1=
FeO(s)+CO(g)的平衡常数为K1=![]() ;
;
化学反应②Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2=
FeO(s)+H2(g)的平衡常数为K2=![]() ;
;
反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K=
CO(g)+H2O(g)的平衡常数K=![]() =
=![]() ;
;
973K时K=![]() =
=![]() =0.68,1173K时K=
=0.68,1173K时K=![]() =
=![]() =1.43,故升高温度K值增大,则升高温度平衡正向移动,则正反应为吸热反应;
=1.43,故升高温度K值增大,则升高温度平衡正向移动,则正反应为吸热反应;
(2)当反应达到平衡后,其他条件不变,分离出部分M,即减小生成物浓度,平衡正向移动,则新平衡时,反应物浓度减小,正反应速率相对于原平衡减小;
(3)a.升高温度反应速率增大,所以不能表示Y的逆反应速率,选项a错误;
b.正反应放热,升高温度平衡向逆反应方向进行,M的体积分数减小,选项b正确;
c.正反应放热,升高温度平衡向逆反应方向进行,气体的质量增加,体积不变,混合气体的密度增大,选项c错误;
d.正反应放热,升高温度平衡向逆反应方向进行,X的转化率减小,选项d正确;
答案选b d;
(4)平衡时X是2mol,消耗X是2mol,同时消耗Y是1mol,则剩余Y是1mol,生成M是3mol,反应前后体积不变,可以用物质的量表示浓度计算平衡常数,则该反应的平衡常数K=![]() =6.75;
=6.75;
反应达到平衡后,若再加入3.00molM,3.00molN,则瞬间M变为6mol,则
2X(g)+Y(g) ![]() 3M(g)+N(s)
3M(g)+N(s)
起始量(mol) 2 1 6
转化量(mol)2x x 3x
平衡量(mol)2+2x 1+x 6-3x
则根据平衡常数可知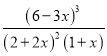 =6.75
=6.75
解得x=0.5
A.重新达平衡后,X的浓度增大,用X表示的υ(正)比原平衡大,选项A正确;
B.重新达平衡后,M的体积分数=![]() =50%,选项B错误;
=50%,选项B错误;
C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍,C正确;
D.重新达平衡后,Y的平均反应速率与原平衡大,D错误;
答案选AC;
(5)由于反应放热,容器内温度升高,化学平衡逆移,c(M)减小,即达平衡后M的物质的量浓度小于1.5mol/L。

【题目】某化学课外活动小组利用废铁屑(含少量硫等元素)为原料制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O],并设计了如图所示的装置(夹持仪器略去)。

称取一定量的表面除去油污的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50~60℃热水浴中加热充分反应。待锥形瓶中溶液冷却至室温后加入氨水,使其反应完全,制得浅绿色悬浊液。
(1)相比通常铁与稀硫酸生成氢气的条件,在实验中选择50~60℃热水浴的原因是___;锥形瓶中溶液冷却至室温后再加入氨水的原因__。
(2)C瓶中KMnO4溶液的作用是__。
(3)若要确保获得浅绿色悬浊液,下列符合实验要求的是__(填字母)。
a.保持铁屑过量
b.控制溶液呈强碱性
c.将稀硫酸改为浓硫酸
(4)莫尔盐是一种重要化学药品,较绿矾稳定,不易被空气氧化,是化学分析中常用的基准物之一。其组成可用(NH4)2SO4FeSO46H2O或(NH4)2Fe(SO4)26H2O表示。一定条件下,(NH4)2Fe(SO4)2发生分解:4(NH4)2Fe(SO4)2=2Fe2O3+5SO2↑+3SO3↑+N2↑+6NH3↑+7H2O下列叙述正确的是__。
a反应生成amolN2时,转移电子的物质的量为6amol
b该反应的还原产物是硫的两种氧化物
c有amol电子转移时,生成SO2的物质的量为0.1amol
d将气体产物用足量BaCl2溶液吸收,只得到一种沉淀物
(5)实验探究:影响溶液中Fe2+稳定性的因素。
配制0.8mol/L的FeSO4溶液(pH=4.5)和0.8mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2ml上述溶液于两支试管中,刚开始两种溶液都呈浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,过了一会儿观察可见(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
(资料)
沉淀 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.6 | 2.7 |
完全沉淀pH | 9.6 | 3.7 |
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其它条件相同时,在一定pH范围内,溶液pH越小Fe2+稳定性越好。
假设3:___。
(6)称取ag所制得的硫酸亚铁铵晶体,用加热煮沸的蒸馏水溶解,配成250mL溶液,取出25mL放入锥形瓶中,用cmol·L-1KMnO4溶液滴定,消耗KMnO4溶液VmL,则硫酸亚铁铵晶体的纯度为___(用含c、V、a的代数式表示)。