��Ŀ����
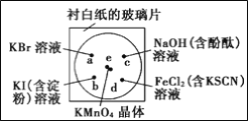
����Ŀ��ij��ѧ����С�����÷���м(���������Ԫ��)Ϊԭ���Ʊ���������茶���[(NH4)2SO4��FeSO4��6H2O]�����������ͼ��ʾ��װ��(�г�������ȥ)��

��ȡһ�����ı����ȥ���۵ķ���м����ƿ�У�����������ϡ���ᣬ��ͨ���������50~60����ˮԡ�м��ȳ�ַ�Ӧ������ƿ����Һ��ȴ�����º���백ˮ��ʹ�䷴Ӧ��ȫ���Ƶ�dz��ɫ����Һ��
��1�����ͨ������ϡ����������������������ʵ����ѡ��50~60����ˮԡ��ԭ����___����ƿ����Һ��ȴ�����º��ټ��백ˮ��ԭ��__��
��2��Cƿ��KMnO4��Һ��������__��
��3����Ҫȷ�����dz��ɫ����Һ�����з���ʵ��Ҫ�����__(����ĸ)��
a.���������
b.������Һ��ǿ����
c.��ϡ�����ΪŨ����
��4��Ī������һ����Ҫ��ѧҩƷ�����̷��ȶ������ױ������������ǻ�ѧ�����г��õĻ���֮һ������ɿ���(NH4)2SO4FeSO46H2O��(NH4)2Fe(SO4)26H2O��ʾ��һ�������£�(NH4)2Fe(SO4)2�����ֽ⣺4(NH4)2Fe(SO4)2=2Fe2O3+5SO2��+3SO3��+N2��+6NH3��+7H2O����������ȷ����__��
a��Ӧ����amolN2ʱ��ת�Ƶ��ӵ����ʵ���Ϊ6amol
b�÷�Ӧ�Ļ�ԭ�������������������
c��amol����ת��ʱ������SO2�����ʵ���Ϊ0.1amol
d���������������BaCl2��Һ���գ�ֻ�õ�һ�ֳ�����
��5��ʵ��̽����Ӱ����Һ��Fe2+�ȶ��Ե����ء�
����0.8mol/L��FeSO4��Һ��pH=4.5����0.8mol/L��(NH4)2Fe(SO4)2��Һ��pH=4.0������ȡ2ml������Һ����֧�Թ��У��տ�ʼ������Һ����dz��ɫ���ֱ�ͬʱ�μ�2��0.01mol/L��KSCN��Һ������һ����۲�ɼ�(NH4)2Fe(SO4)2��Һ��ȻΪdz��ɫ��������Һ��FeSO4��Һ����ֵ���ɫ���ǡ�
�����ϣ�
���� | Fe(OH)2 | Fe(OH)3 |
��ʼ����pH | 7.6 | 2.7 |
��ȫ����pH | 9.6 | 3.7 |
���������ӷ���ʽ����FeSO4��Һ��������ɫ���ǵ�ԭ��___��
������Ӱ��Fe2+�ȶ��Ե����أ�С��ͬѧ�������3�ּ��裺
����1������������ͬʱ��NH4+�Ĵ���ʹ(NH4)2Fe(SO4)2��Һ��Fe2+�ȶ��ԽϺá�
����2������������ͬʱ����һ��pH��Χ�ڣ���ҺpHԽСFe2+�ȶ���Խ�á�
����3��___��
��6����ȡag���Ƶõ���������茶��壬�ü�����е�����ˮ�ܽ⣬���250mL��Һ��ȡ��25mL������ƿ�У���cmol��L-1KMnO4��Һ�ζ�������KMnO4��ҺVmL������������茶���Ĵ���Ϊ___(�ú�c��V��a�Ĵ���ʽ��ʾ)��
���𰸡����Ⱦ��ȣ��ӿ췴Ӧ���� �¶ȹ��ߣ���ˮ�ӷ����࣬ԭ�������ʵ� �������⡢�������������� a d 4Fe2++O2+10H2O=4Fe(OH)3��+8H+ ������������ͬʱ�����������Ũ��Խ��Fe2+���ȶ��ԽϺá���������������ͬʱ�����������Ũ�ȴ�СӰ��Fe2+���ȶ��ԡ��� ![]()
��������
����м��������������������������Һ��ˮԡ���ȣ��ɼӿ췴Ӧ���ʺ����Ⱦ��ȣ�����������������壬����KMnO4��Һ���գ���Ӧ�����Һ�������ۣ���ֹ������������������ȴ����백ˮ���Ƶ�dz��ɫ����Һ����������������泥���KMnO4��Һ���ⶨ��������淋Ĵ��ȣ�����5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O���Դ˽����⡣
��1����ʵ����ѡ��50��60����ˮԡ�������¶ȣ����Ⱦ��ȣ��ӿ췴Ӧ���ʣ���������ʣ� ��ƿ����Һ��ȴ�����º��ټ��백ˮ������Ϊ��ˮ�еİ����ӷ����¶ȹ��ߣ���ˮ�ӷ����࣬ԭ�������ʵͣ������ڷ�Ӧ�Ľ��У���Ϊ�ӿ췴Ӧ���ʣ����Ⱦ��ȣ��¶ȹ��ߣ���ˮ�ӷ����࣬ԭ�������ʵ͡�
��2��������м�к���S����˻����SO2��ͬʱ��ˮ�ӷ�����˸��������Һ������Щ���壬��ֹ��Ⱦ��������Ϊ���հ���������������������壬��ֹ��Ⱦ������
��3����Ҫȷ�����dz��ɫ����Һ������Fe2+�ױ�����������Ϊ��ֹ�䱻��������мӦ��������a��ȷ����������Һ��ǿ���ԣ���������Fe(OH)2��������b����ϡ�����ΪŨ���ᣬ����ŨH2SO4��ǿ�����ԣ��ὫFe2+������Fe3+����c����Ϊa��
��4����4(NH4)2Fe(SO4)2=2Fe2O3+5SO2��+3SO3��+N2��+6NH3��+7H2O��֪��FeԪ����+2�۱�Ϊ+3�ۣ�ʧ���ӣ�NԪ����-3�۱�Ϊ0�ۣ�ʧ���ӣ�SԪ����+6���Ϊ+4�ۣ��õ��ӣ����ɷ���ʽ��֪��
a������1molN2ͬʱ������5molSO2��ת�Ƶ���10mol����ô��Ӧ����amolN2ʱ��ת�Ƶ��ӵ����ʵ���10amol��Ϊ��a����
b���õ����ӱ���ԭ�����ɻ�ԭ�����ԭ����ֻ��SO2��SO3��S��̬���䣬���ǻ�ԭ�����b����
c���ɷ���ʽ��֪������5molSO2������ת��10mol������amol����ת��ʱ������SO2�����ʵ�����0.5amol����c����
d����������BaCl 2 �����������ʱ��ֻ������BaSO 4 ����������������BaSO 3 ��������d��ȷ����Ϊd��
��5����FeSO4��Һ��������ɫ��������Ϊ������Fe(OH)3���������ӷ���ʽΪ��4Fe2++O2+10H2O=4Fe(OH)3��+8H+����Ϊ4Fe2++O2+10H2O=4Fe(OH)3��+8H+��
������������Һ����Ũ�ȵIJ����ж�,NH4+��SO42-�Լ�H+����Ӱ��Fe2+�ȶ���,�������Ϣ��֪,����1�ͼ���2��˵��NH4+��H+��Ӱ�죬���֪����3�ǽ��������Ӱ�죬������������ͬʱ,���������Ũ�ȴ�СӰ��Fe2+���ȶ���(������������ͬʱ�����������Ũ��Խ��Fe2+���ȶ��ԽϺ�)����Ϊ������������ͬʱ�����������Ũ�ȴ�СӰ��Fe2+���ȶ���(������������ͬʱ�����������Ũ��Խ��Fe2+���ȶ��ԽϺ�)��
��6���ɷ�Ӧ5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O����֪5Fe2+��MnO4-����Ӧ����KMnO4�����ʵ���Ϊn(MnO4-)=cmol��L-1��V��10-3L=cV��10-3mol��250mL���������ӵ����ʵ���Ϊn(Fe2+)=5��cV��10-3mol��![]() =5cV��10-2mol����(NH4)2Fe(SO4)2����Ϊ5cV��10-2mol��392g/mol=19.6 cVg������������茶���Ĵ���Ϊ
=5cV��10-2mol����(NH4)2Fe(SO4)2����Ϊ5cV��10-2mol��392g/mol=19.6 cVg������������茶���Ĵ���Ϊ![]() ��100%����Ϊ
��100%����Ϊ![]() ��100%��
��100%��

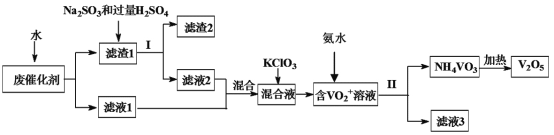
����Ŀ�������������㷺����ұ�𡢻�������ҵ�������Ͻ����Ӽ������������ʯ�;����õĴ����ȡ�Ϊ�������ú���������������һ�����÷ϴ���������V2O5��VOSO4�������Թ����Σ�����V2O5���¹���������ͼ��
��֪����1�����ֺ������ʳ�������ˮ�е��ܽ��������ʾ��
���� | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
�ܽ��� | ���� | ���� | ���� | ���� |
��2��VO2++OH-![]() VO3-+H2O
VO3-+H2O
�ش��������⣺
��1����ˮ���ݷϴ�����Ϊ����ߵ�λʱ���ڷϷ��Ľ����ʣ��ڲ����Լ�����£����Բ�ȡ�Ĵ�ʩΪ__��дһ������
��2����Һ1����Һ2�з��Ĵ�����ʽ��ͬ���������ʽΪ__�������ӷ��ţ���
��3��ÿ����1mol��VO2��2SO4ʱת�Ƶ��ӵ���ĿΪ___��
��4��������1�м���Na2SO3����H2SO4��Һ������Ӧ�����ӷ���ʽΪ___��
��5����ϻ�ѧ�����ƽ���ƶ�ԭ�����ͼ��백ˮ��һ������Ϊ__��
��6���¹������̵������NH4VO3����ʽ������������ͼ�к������ʾ��ӦII���¶ȣ��������ʾ�����ʣ���������ָNH4VO3������VԪ�ص������ͷϴ�����VԪ�ص�����֮�ȣ�Ҳ���Ƿ��Ļ����ʡ������ͼ���¶ȳ���80���Ժ������½��Ŀ���ԭ����___��
��7���ù��������п���ѭ�����õ�����Ϊ__��
��8����ʵ�����õ�ԭ����V2O5ռ6%(ԭ���е����з��ѻ����V2O5)��ȡ100�˸÷Ϸ���������ҵ�����IJ������ʵ�顣������100mL0.1mol/L��KClO3��Һʱ����Һ�еķ�ǡ�ñ���ȫ������������KClO3��Ӧ��IJ��������з�û����ʧ�����ʵ���з��Ļ�������__������3λ��Ч���֣���
����Ŀ��I. CO2��Ŀǰ�����к�����ߵ�һ���������塣��ˣ����ƺ�����CO2�ǽ������ЧӦ����Ч;����
��֪��ӦFe��s��+CO2��g��![]() FeO��s��+CO��g����ƽ�ⳣ��ΪK1��
FeO��s��+CO��g����ƽ�ⳣ��ΪK1��
��ӦFe��s��+H2O��g��![]() FeO��s��+H2��g����ƽ�ⳣ��ΪK2��
FeO��s��+H2��g����ƽ�ⳣ��ΪK2��
�ڲ�ͬ�¶�ʱK1��K2��ֵ���±���
�¶� | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
��1���Ƶ���ӦCO2��g��+H2��g��![]() CO��g��+H2O��g����ƽ�ⳣ��K��K1��K2�Ĺ�ϵʽ��_________���жϸ÷�Ӧ��_____________��Ӧ������ȡ����ȡ�����
CO��g��+H2O��g����ƽ�ⳣ��K��K1��K2�Ĺ�ϵʽ��_________���жϸ÷�Ӧ��_____________��Ӧ������ȡ����ȡ�����
II. T1�¶��£����Ϊ2L�ĺ����ܱ�����������4.00molX��2.00molY��������ѧ��Ӧ 2X(g)+Y(g) ![]() 3M(g)+N(s) ��H<0��
3M(g)+N(s) ��H<0��
����ʵ���������£�
t/s | 0 | 500 | 1000 | 1500 |
n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
��2������Ӧ�ﵽƽ��������������䣬���������M������ƽ��ʱ������Ӧ���������ԭƽ��____________�����������С�������䡱����
��3���÷�Ӧ�ﵽƽ��ʱij���������¶ȱ仯����ͼ��ʾ����������Ա�ʾ������������Щ____��

a��Y���淴Ӧ����
b��M���������
c�����������ܶ�
d��X��ת����
��4����Ӧ�ﵽƽ������ټ���3.00molM��3.00molN������˵����ȷ����_____________��
A�����´�ƽ�����X��ʾ����(��)��ԭƽ���
B�����´�ƽ���M���������С��50%
C�����´�ƽ���M�����ʵ���Ũ����ԭƽ���1��5��
D�����´�ƽ���Y��ƽ����Ӧ������ԭƽ�����
��5��������Ϊ���Ⱥ�����������ʼʱ����4.00molX��2.00molY�����ƽ���M�����ʵ���Ũ��____________1.5mol/L(����ڡ�����С�ڡ����ڡ�)��
����Ŀ����CH4��H2OΪԭ�ϣ�ͨ�����з�Ӧ���Ʊ��״���
I��CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ��H��+206.0kJ��mol��1
CO(g) + 3H2(g) ��H��+206.0kJ��mol��1
II��CO(g) + 2H2(g) ![]() CH3OH(g) ��H����129.0kJ��mol��1
CH3OH(g) ��H����129.0kJ��mol��1
��1��һ���¶��£����ݻ�2L�ҹ̶��������ܱ������У������·�ʽ���뷴Ӧ�����ӦI��һ��ʱ���ﵽƽ�⡣
�� �� | �� | �� |
��Ӧ��Ͷ���� | 1molCH4��1molH2O | a molCH4��a molH2O��b molCO��c molH2 |
���ⶨ����������5min�ﵽƽ�⣬ƽ�����������ѹǿΪ��ʼ��1.2������Ҫʹƽ������������ͬ��ֵ����������ȣ�����ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ������У���b��ȡֵ��ΧΪ__________��
��2����1.0molCH4��2.0molH2O(g)ͨ���ݻ�Ϊ10L�ķ�Ӧ�ң���һ�������·�����ӦI�������һ����ѹǿ��CH4��ת�������¶ȵĹ�ϵ��ͼ��
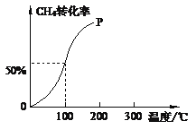
������100 ��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ�÷�Ӧ�ķ�Ӧ����Ϊ______��
��100��ʱ��ӦI��ƽ�ⳣ��Ϊ____________��
��3�����ں��º�ѹ�����ڽ��з�ӦII��������˵���÷�Ӧ�ﵽƽ��״̬����________������ţ���
A����2��H��H�����ɵ�ͬʱ�� 3��C��H������
B��CO�ٷֺ������ֲ���
C�������л�������ѹǿ���ֲ���
D�������л��������ܶȱ��ֲ���
��4����ѹǿΪ0.1MPa���¶�Ϊ300�������£���amol CO��3amol H2�Ļ�������ڴ��������·�����ӦII���ɼ״���ƽ����������ݻ�ѹ����ԭ����l/2�������������䣬��ƽ����ϵ������Ӱ����__________������ţ���
A��c(H2) ���� B������Ӧ���ʼӿ죬�淴Ӧ���ʼ���
C��n(CH3OH) ���� D��![]() ��С E��ƽ�ⳣ��K����
��С E��ƽ�ⳣ��K����
����Ŀ�������й�ʵ�����������ͽ��ͻ���۶���ȷ����
ѡ�� | ʵ����� | ���� | ���ͻ���� |
A | ������Fe���м���HNO3����ַ�Ӧ����KSCN��Һ | ��Һ�ʺ�ɫ | ϡ |
B | CO2ͨ��BaCl2��Һ�� | �а�ɫ�������� | ������BaCO3���� |
C | Al������ϡ | ������ | Al�����汻 |
D | �ò�����պȡŨ����㵽��ɫʯ����ֽ�� | ��ֽ�ȱ��ɫ����ɫ | Ũ���������Ժ������� |
A.AB.BC.CD.D