题目内容
19.某溶液中大量存在以下浓度的五种离子:0.2mol/L Cl-、0.4mol/L SO${\;}_{4}^{2-}$、0.1mol/L Al3+、0.3mol/L H+、M,则M及物质的量浓度(mol/L)可能为( )| A. | Na+0.3 | B. | Ba2+0.2 | C. | CO${\;}_{3}^{2-}$ 0.2 | D. | Zn2+0.2 |
分析 根据溶液中电荷守恒判断M离子的电性,c(Cl-)+2c(SO42-)=0.2mol/L Cl-+2×0.4mol/L=1mol/L,3c(Al3+)+c(H+)=3×0.1mol/L+0.3mol/L=0.6mol/L,所以M为阳离子,令M阳离子为c(Mn+),根据电荷守恒有nc(Mn+)=1mol/L-0.6mol/L=0.4mol/L,再结合选项考虑离子共存判断.
解答 解:根据溶液中电荷守恒判断M离子的电性,c(Cl-)+2c(SO42-)=0.2mol/L Cl-+2×0.4mol/L=1mol/L,3c(Al3+)+c(H+)=3×0.1mol/L+0.3mol/L=0.6mol/L,所以M为阳离子,令M阳离子为c(Mn+),根据电荷守恒有nc(Mn+)=1mol/L-0.6mol/L=0.4mol/L,
A.1×c(Na+)=0.3 mol/L,故A错误;
B.钡离子与硫酸根离子反应生成硫酸钡沉淀,不可能为钡离子,故B错误;
C.由上述分析可知,M为阳离子,不可能是CO32-,故C错误;
D.2×c(Zn2+)=2×0.2mol/L=0.4mol/L,符合条件,故D正确;
故选D.
点评 本题考查物质的量浓度的计算、离子共存等知识,题目难度中等,明确电荷守恒为解答关键,需要结合计算、离子共存判断溶液中可能存在的离子,注意B选项中学生容易忽略离子的共存.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.水的三态的熵值的大小关系正确的是( )
| A. | S (s)>S (l)>S (g) | B. | S (g)>S (l)>S (s) | C. | S (l)>S (s)>S (g) | D. | S (g)>S (s)>S (l) |
10.在用Zn、Cu片和稀H2SO4组成的原电池装置中,经过一段时间工作后,下列说法中正确的是( )
| A. | 锌片是正极,铜片上有气泡产生 | B. | 溶液中H2SO4 的物质的量减少 | ||
| C. | 电流方向是从锌片流向铜片 | D. | 电解液的pH保持不变 |
7.焙制糕点时,常用到小苏打粉,小苏打的化学式为( )
| A. | NaNO3 | B. | Na2CO3 | C. | NaHCO3 | D. | Na2SO4 |
14.在恒容密闭容器中通入X、Y、Z发生反应:2X(g)?Y(g)+C(s),已知温度T1>T2,X的物质的量浓度c(X)随时间t变化曲线如图甲,速率变化如图乙,下列叙述不正确的是( )


| A. | 如图甲在T2线上,正反应速率:N点>W点 | |
| B. | 如图甲在T2下,在0~t1时间内的平均速率,v(X)=$\frac{a-b}{{t}_{1}}$ mol•L-1•min-1 | |
| C. | 增加C的量,化学反应速率增大 | |
| D. | 如图乙,t0时可能是加入了催化剂 |
4.某酯在稀硫酸中水解得到甲和乙,且甲和乙的相对分子量相等,则该酯可能为( )
| A. | 甲酸甲酯 | B. | 乙酸乙酯 | C. | 甲酸乙酯 | D. | 乙酸甲酯 |
11.下列各组离子在指定溶液中能大量共存的是( )
| A. | 无色溶液中:K+、Na+、Fe2+、SO42- | |
| B. | 在碱性溶液中:Ba2+、Na+、SO42-、Cl- | |
| C. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 含大量Fe3+溶液中:K+、Cl-、SO42-、Na+ |
8. 25℃时,部分物质的电离常数如表所示:
25℃时,部分物质的电离常数如表所示:
请回答下列问题:
(1)a.CH3COOH,b.H2CO3,c.HClO的酸性由强到弱的顺序为a>b>c(填编号).
(2)同浓度的a.CH3COO-,b.HCO${\;}_{3}^{-}$,c.CO${\;}_{3}^{2-}$,d.ClO-结合H+的能力由强到弱的顺序为c>d>b>a(填编号).
(3)向NaClO溶液中通入少量的CO2,反应的离子方程式为ClO-+CO2+H2O=HCO3-+HClO.
(4)pH相同的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,物质的量浓度由大到小的顺序是c>d>b>a(填编号).
(5)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填序号).
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D. c(H+)•c(CH3COO-)/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是ABCD.
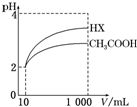
(6)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离常数大于(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
 25℃时,部分物质的电离常数如表所示:
25℃时,部分物质的电离常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)a.CH3COOH,b.H2CO3,c.HClO的酸性由强到弱的顺序为a>b>c(填编号).
(2)同浓度的a.CH3COO-,b.HCO${\;}_{3}^{-}$,c.CO${\;}_{3}^{2-}$,d.ClO-结合H+的能力由强到弱的顺序为c>d>b>a(填编号).
(3)向NaClO溶液中通入少量的CO2,反应的离子方程式为ClO-+CO2+H2O=HCO3-+HClO.
(4)pH相同的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,物质的量浓度由大到小的顺序是c>d>b>a(填编号).
(5)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填序号).
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D. c(H+)•c(CH3COO-)/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是ABCD.
(6)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离常数大于(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
9.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到直观形象的效果,下列表达不正确的是( )
| 选项 | 反应叙述 | 产物图示 |
| A | NaOH溶液与SO2 反应时溶液中的溶质 |  |
| B | NaAlO2溶液与盐酸反 应后铝元素的存在形式 |  |
| C | Fe和稀HNO3反应 后,铁元素的存在形式 | 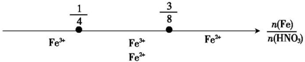 |
| D | Fe在Cl2中的燃烧产物 |  |
| A. | A | B. | B | C. | C | D. | D |