题目内容
9.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到直观形象的效果,下列表达不正确的是( )| 选项 | 反应叙述 | 产物图示 |
| A | NaOH溶液与SO2 反应时溶液中的溶质 | 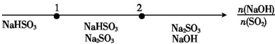 |
| B | NaAlO2溶液与盐酸反 应后铝元素的存在形式 |  |
| C | Fe和稀HNO3反应 后,铁元素的存在形式 |  |
| D | Fe在Cl2中的燃烧产物 |  |
| A. | A | B. | B | C. | C | D. | D |
分析 A、根据可能发生的反应2NaOH+SO2(少量)═Na2SO3+H2O,NaOH+SO2(足)═NaHSO3分析;
B、NaAl02溶液与盐酸反应后铝的存在形式和量有关,盐酸少生成产物氢氧化铝和剩余偏铝酸钠,盐酸和偏铝酸钠全部反应可以是氢氧化铝和氯化铝或氯化铝,盐酸过量最后为氯化铝;
C、依据铁和稀硝酸的定量反应分析判断;
D、Fe在Cl2中燃烧的产物与Fe和Cl2的用量无关,其产物只有FeCl3.
解答 解:A、烧碱溶液中通入少量二氧化硫反应生成亚硫酸钠,n(NaOH):n(SO2)=2:1反应生成亚硫酸钠,通入过量二氧化硫生成亚硫酸氢钠,n(NaOH):n(SO2)=1:1,反应生成亚硫酸氢钠,在2:1~1:1范围内生成亚硫酸钠和亚硫酸氢钠,故A正确;
B、NaAl02溶液与盐酸反应后铝的存在形式和量有关,盐酸少生成产物氢氧化铝和剩余偏铝酸钠,盐酸和偏铝酸钠全部反应可以是氢氧化铝和氯化铝或氯化铝,盐酸过量最后为氯化铝;NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,NaAlO2+4HCl=AlCl3+NaCl+2H2O,n(HCl):n(NaAlO2)≤1:1,为AlO2-,Al(OH)3,n(HCl):n(NaAlO2)≥1:4,存在Al3+,1:1~1:4存在Al(OH)3,AlCl3,数轴符合,故B正确;
C、反应的化学方程式:4HNO3(稀足)+Fe═Fe(NO3)3+NO↑+2H2O,8HNO3+3Fe═3Fe(NO3)2+2NO↑+4H2O,Fe与HNO3的物质的量之比为1:4时,恰好反应生成Fe(NO3)3,即Fe与HNO3的物质的量之比为≤$\frac{1}{4}$时反应得到Fe(NO3)3,Fe与HNO3的物质的量之比为3:8时,恰好反应生成Fe(NO3)2,即Fe与HNO3的物质的量之比为≥$\frac{3}{8}$时反应得到Fe(NO3)2,故C正确;
D、Fe在Cl2中燃烧只有一种产物FeCl3,故D错误;
故选D.
点评 本题考查了常见的用数轴法表示化学知识,完成此题,可以依据已有的知识进行,所以要求同学们在平时的学习中加强基础知识的储备,以便能够灵活应用.

| A. | Na+0.3 | B. | Ba2+0.2 | C. | CO${\;}_{3}^{2-}$ 0.2 | D. | Zn2+0.2 |
| A. | 当消耗0.1 mol Zn时,得到的还原产物为0.1 mol | |
| B. | 反应结束时,可得到0.25 mol ZnSO4 | |
| C. | 当溶液中不再产生气泡时,溶液中大量存在的阳离子只有Zn2+ | |
| D. | 最后生成的单质为Fe |
| A. | 容器I、II中正反应速率相同 | |
| B. | 容器I中CO 的物质的量比容器II中的多 | |
| C. | 容器I、III中反应的平衡常数相同 | |
| D. | 容器I中CO 的转化率与容器II中CO2 的转化率之和等于1 |

| A. | S(s,单斜)=S(s,正交)△H=+0.33kJ/mol | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | 1molSO2(g)分解成lmol S(s,单斜)和lmol O2(g)时会放出热量 |