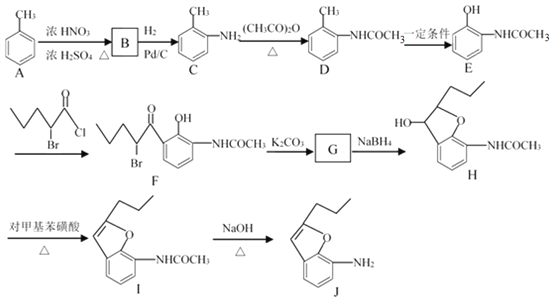
题目内容
【题目】工业从废铅酸蓄电池的渣泥(主要成分为PbSO4、PbO2)回收铅。RSR 工艺的主要流程如下:
![]()
(1)铅酸蓄电池放电时总反应为:
Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O(l)
正极反应:PbO2(s) + SO42-(aq) + 4H+(aq) + 2e- = PbSO4(s) + 2H2O(l)
负极反应:________。
(2)向渣泥中加入Na2CO3溶液将PbSO4转化为更难溶的PbCO3。
①用化学平衡移动原理解释其原因:________。
②工业上常用NaHCO3溶液代替Na2CO3溶液,将PbSO4转化为PbCO3。PbSO4与NaHCO3溶液或Na2CO3溶液不同物质的量比时,PbSO4的转化率见下表。
Ⅰ | n(PbSO4)∶ n(NaHCO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4转化率/% | 95.5 | 96.9 | 97.8 | |
Ⅱ | n(PbSO4)∶ n(Na2CO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4转化率/% | 98 | 98 | 98 |
依据上表数据,物质的量比相同时,Ⅱ中PbSO4的转化率比Ⅰ中的略大,原因是________。
③上述反应除生成PbCO3外,还可能生成碱式碳酸铅[2PbCO3·Pb(OH)2],二者受热都易分解生成PbO。通过实验确定产物中含有2PbCO3·Pb(OH)2,则该实验操作及现象是________;通过定量实验确定产物中2PbCO3·Pb(OH)2的含量,则需测定的数据是________。
(3)渣泥中加入Na2SO3溶液,利用其性质是________。
(4)H2SiF4溶液溶解PbCO3的化学方程式是________。
【答案】 Pb(s) + SO42-(aq) -2 e- = PbSO4(s) PbSO4浊液中存在平衡PbSO4(s)![]() Pb2+(aq) + SO42(aq),Na2CO3溶液中的CO32与Pb2+结合生成更难溶的PbCO3,c(Pb2+)降低,平衡正向移动,即发生反应PbSO4(s)+CO32 (aq)
Pb2+(aq) + SO42(aq),Na2CO3溶液中的CO32与Pb2+结合生成更难溶的PbCO3,c(Pb2+)降低,平衡正向移动,即发生反应PbSO4(s)+CO32 (aq) ![]() PbCO3(s)+SO42 (aq) 与PbSO4物质的量比相同时,Na2CO3溶液中c(CO32-)比NaHCO3溶液中的大 取一定量样品充分干燥后加热,将产生的气体通过盛有无水硫酸铜的干燥管,无水硫酸铜变蓝色,说明样品含有2PbCO3·Pb(OH)2 干燥后样品的质量m1,充分加热、冷却后固体的质量m2 (答案合理即得分) 还原性 PbCO3 + H2SiF4 = PbSiF4 + CO2↑ + H2O
PbCO3(s)+SO42 (aq) 与PbSO4物质的量比相同时,Na2CO3溶液中c(CO32-)比NaHCO3溶液中的大 取一定量样品充分干燥后加热,将产生的气体通过盛有无水硫酸铜的干燥管,无水硫酸铜变蓝色,说明样品含有2PbCO3·Pb(OH)2 干燥后样品的质量m1,充分加热、冷却后固体的质量m2 (答案合理即得分) 还原性 PbCO3 + H2SiF4 = PbSiF4 + CO2↑ + H2O
【解析】(1)铅酸蓄电池放电时总反应为:Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O(l);正极反应:PbO2(s) + SO42-(aq) + 4H+(aq) + 2e- = PbSO4(s) + 2H2O(l);根据电池中电极总反应式-正极反应=负极反应可得负极反应:Pb(s) + SO42-(aq) -2 e- = PbSO4(s) ;(2)①PbSO4浊液中存在平衡PbSO4(s)![]() Pb2+(aq) + SO42(aq),Na2CO3溶液中的CO32与Pb2+结合生成更难溶的PbCO3,c(Pb2+)降低,平衡正向移动,即发生反应PbSO4(s)+CO32 (aq)
Pb2+(aq) + SO42(aq),Na2CO3溶液中的CO32与Pb2+结合生成更难溶的PbCO3,c(Pb2+)降低,平衡正向移动,即发生反应PbSO4(s)+CO32 (aq) ![]() PbCO3(s)+SO42 (aq),故向渣泥中加入Na2CO3溶液将PbSO4转化为更难溶的PbCO3;②与PbSO4物质的量比相同时,Na2CO3溶液中c(CO32-)比NaHCO3溶液中的大,故Ⅱ中PbSO4的转化率比Ⅰ中的略大;③取一定量样品充分干燥后加热,将产生的气体通过盛有无水硫酸铜的干燥管,无水硫酸铜变蓝色,说明样品含有2PbCO3·Pb(OH)2;通过定量实验确定产物中2PbCO3·Pb(OH)2的含量,则需测定的数据是干燥后样品的质量m1,充分加热、冷却后固体的质量m2;(3)渣泥中加入Na2SO3溶液,利用其性质是还原性,将PbO2还原;(4)H2SiF4溶液溶解PbCO3生成PbSiF4,同时生成二氧化碳和水,反应的化学方程式是PbCO3 + H2SiF4 = PbSiF4 + CO2↑ + H2O。
PbCO3(s)+SO42 (aq),故向渣泥中加入Na2CO3溶液将PbSO4转化为更难溶的PbCO3;②与PbSO4物质的量比相同时,Na2CO3溶液中c(CO32-)比NaHCO3溶液中的大,故Ⅱ中PbSO4的转化率比Ⅰ中的略大;③取一定量样品充分干燥后加热,将产生的气体通过盛有无水硫酸铜的干燥管,无水硫酸铜变蓝色,说明样品含有2PbCO3·Pb(OH)2;通过定量实验确定产物中2PbCO3·Pb(OH)2的含量,则需测定的数据是干燥后样品的质量m1,充分加热、冷却后固体的质量m2;(3)渣泥中加入Na2SO3溶液,利用其性质是还原性,将PbO2还原;(4)H2SiF4溶液溶解PbCO3生成PbSiF4,同时生成二氧化碳和水,反应的化学方程式是PbCO3 + H2SiF4 = PbSiF4 + CO2↑ + H2O。

 阅读快车系列答案
阅读快车系列答案【题目】粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是燃煤发电过程中产生的废渣。粉煤灰的综合利用具有很大的价值。
(1)煤炭在火炉中燃烧很旺时,在往炉膛内的热煤炭上喷洒少量水的瞬间,炉子内火会更旺。如果烧去同量的煤炭,喷洒过水的和没有喷洒过水的煤炭相比较,它们放出的总热量___(填“相同”或“不相同”)。这是因为:________________________。
(2)研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究。
①以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离。向分离所得的滤液中加入还原剂使Fe3+转化为Fe2+,结合下表分析其原因:___________________
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~895 | 1.94~3.20 | 3.69~4.8 |
②使用碱性较弱的氨水为pH调节剂,进行分离实验。反应终点的pH对铝和铁分离效果的影响如图1。根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是____________。
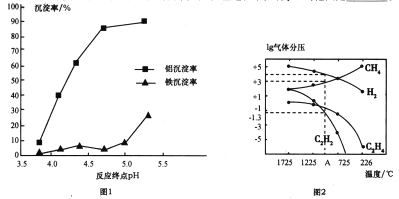
(3)工业上可利用煤的气化产物(水煤气)合成甲烷研究得出,甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图2所示。
①T℃时,向1L恒容密闭容器中充入0.3molCH4只发生反应2CH4(g)![]() C2H4(g)+2H2(g)。达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H___(填“>”或“<”)0,CH4的平衡转化率为________。
C2H4(g)+2H2(g)。达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H___(填“>”或“<”)0,CH4的平衡转化率为________。
②列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数Kp=________(用平衡分压代替平衡浓度列式计算,不要求写单位,lg0.05=-1.3)。
C2H2(g)+3H2(g)在图中A点温度时的平衡常数Kp=________(用平衡分压代替平衡浓度列式计算,不要求写单位,lg0.05=-1.3)。