题目内容
14. A、B、C、D均是由短周期元素形成的四种气体单质,E、F均为气体,且F为红棕色.有关的转化关系如图所示(反应条件均已略去):
A、B、C、D均是由短周期元素形成的四种气体单质,E、F均为气体,且F为红棕色.有关的转化关系如图所示(反应条件均已略去):请回答下列问题:
(1)D的化学式为H2.
(2)反应③的离子方程式为3NO2+H2O=2H++2NO3-+NO.
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为4NH3+6NO=5N2+6H2O.
(4)0.1mol•L-1 X溶液和0.1mol•L-1 Y溶液等体积混合,溶液呈酸(填“酸”、“碱”或“中”)性,原因是NH4++H2O?NH3•H2O+H+(用离子方程式说明).
分析 X与Y反应生成H是白烟,应是挥发性酸和氨气相遇后的产物,由此可推知D是H2,突破口之二是“红棕色气体”,F应为NO2,反推可知E为NO,C为O2,Z为H2O,Y为NH3,X为HCl,G为HNO3,则A为Cl2,B为N2,以此结合物质的性质可解答该题.
解答 解:X与Y反应生成H是白烟,应是挥发性酸和氨气相遇后的产物,由此可推知D是H2,突破口之二是“红棕色气体”,F应为NO2,反推可知E为NO,C为O2,Z为H2O,Y为NH3,X为HCl,G为HNO3,则A为Cl2,B为N2,
(1)由以上分析可知D为H2,
故答案为:H2;
(2)③为NO2与H2O的反应,反应的离子方程式为3NO2+H2O=2H++2NO3-+NO,
故答案为:3NO2+H2O=2H++2NO3-+NO;
(3)E为NO,为污染性气体,在一定条件下可与NH3反应生成N2和H2O,反应的化学方程式为4NH3+6NO=5N2+6H2O,
故答案为:4NH3+6NO=5N2+6H2O;
(4)两者恰好完全反应时生成NH4Cl,为强酸弱碱盐,溶液中存在NH4++H2O?NH3•H2O+H+,铵根离子水解而使溶液显酸性,
故答案为:酸;NH4++H2O?NH3•H2O+H+.
点评 本题考查物质的推断,题目难度中等,本题注意从物质反应的典型现象作为该题的突破口,该题中注意把握盐类的水解以及弱电解质的电离.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列物质不属于毒品的是( )
| A. | 吗啡 | B. | 青霉素 | C. | 海洛因 | D. | 冰毒 |
19.下列说法正确的是( )
| A. | 氯碱工业中阳离子交换膜的主要作用是防止氯气和氢气以及氢氧化钠反应 | |
| B. | 硫酸工业中合成SO3通常采用常压,是因为常压比高压更有利于SO3的生成 | |
| C. | 电解精炼铜时,粗铜作阳极,纯铜作阴极 | |
| D. | 工业合成氨通常采用400~500℃的高温主要是为了提高氮气的转化率 |
6.许多马路两旁的树干都均匀地涂抹了石灰水.下列有关说法正确的是( )
| A. | 饱和石灰水加入生石灰,若温度不变,则溶液中Ca2+的物质的量不变 | |
| B. | 饱和石灰水加入生石灰,若温度不变,则pH不变 | |
| C. | 升高饱和石灰水的温度时,Ca(OH)2的溶度积常数Ksp不变 | |
| D. | 石灰水显碱性,能使蛋白质变性,所以有防治树木害虫病的作用 |
3.硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
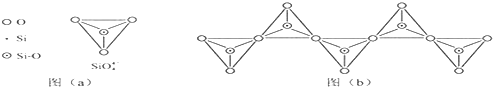
(6)在硅酸盐中,SiO44-四面体;如图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为SiO32-.
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO44-四面体;如图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为SiO32-.

 ;
;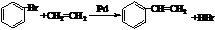 ;
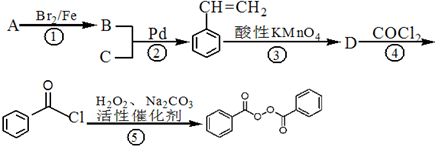
; ),在一定条件下能发生银镜反应,且1molE最多可消耗4mol NaOH
),在一定条件下能发生银镜反应,且1molE最多可消耗4mol NaOH 的流程,无机物任选,注明反应条件.
的流程,无机物任选,注明反应条件.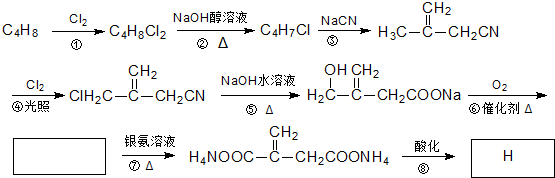
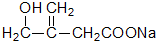 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2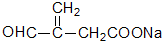 +2H2O;其反应类型是氧化反应;
+2H2O;其反应类型是氧化反应; 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计了下列实验图以确认上述混合气体中有CH2=CH2和SO2.
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计了下列实验图以确认上述混合气体中有CH2=CH2和SO2.