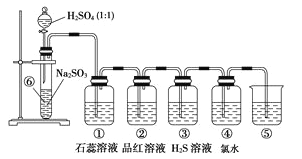
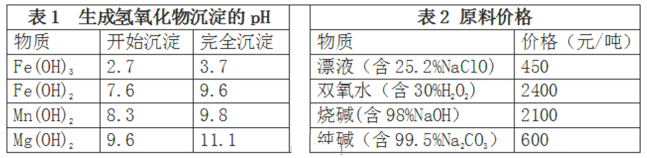
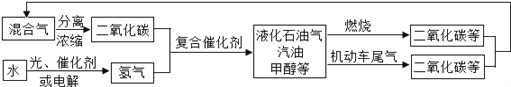
��Ŀ����
����Ŀ�����������£����ڿ��淴ӦX (g)+4Y(g)![]() 2Z(g)����X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3(����Ϊ��)���ﵽƽ��ʱ��X��Y��Z��Ũ�ȷքeΪ0.lmol/L��0.4mol/L��0.1mol/L���������ж���ȷ����( )
2Z(g)����X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3(����Ϊ��)���ﵽƽ��ʱ��X��Y��Z��Ũ�ȷքeΪ0.lmol/L��0.4mol/L��0.1mol/L���������ж���ȷ����( )
A. c1��c2=4��1
B. ƽ��ʱ��Y��Z����������֮��Ϊ1: 2
C. c1��ȡֵ��ΧΪ0mol/L<c1<0.14mol/L
D. ����Ӧ������У�X��Y��ת�������
���𰸡�D
��������A��ɷ���ʽ�ɵã�X��Y��1:4��Ӧ������Ϊƽ��ʱX��Y��Ũ��֮��Ϊ1:4������X��Y��ʼŨ��֮��Ϊ1:4����A����B�ƽ��ʱ����ͬ���ʱ�ʾ������������֮�ȵ��ڻ�ѧ������֮�ȣ�����Y��Z����������֮��Ϊ4:2����2:1����B������C�����Ӧ�����ƶ��ﵽƽ�⣬��c1��ֵ���ƽ��ʱX��Ũ��Ϊ0.1mol/L��Z��Ũ��Ϊ0.1mol/L����ΪZ��Ũ�ȿ�ʼ����0����Z��Ũ�ȱ仯С��0.1mol/L���ɷ���ʽ��֪��X��Ũ�ȱ仯��С��0.05mol/L����c1��0.15mo/L������Ӧ�����ƶ�����ƽ�⣬��c1��ֵ��С��ƽ��ʱX��Y��Ũ��Ϊ1��4�����ڻ�ѧ��������������Z�ֽ����ɣ���ΪX����ʼŨ�ȴ���0������0��c1��0.15mo/L����C������D���A��ķ����ɵã�X��Y��ʼŨ��֮��Ϊ1:4������ΪX��Y��1:4�����ʵ���֮�ȷ�Ӧ������X��Y��ת������ȣ���D��ȷ��