题目内容
【题目】亚铁氰化钾的化学式为K4Fe(CN)6,一种用含NaCN废水合成该化合物的主要工艺流程如下:
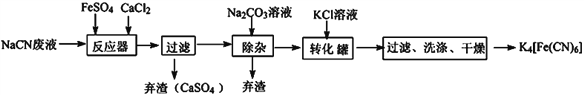
(1)请依据工艺流程图中的信息,回答下列问题:
①在“除杂”步骤中弃渣的主要成分为__________________(填化学式)。
②在“反应器“中发生的主要反应的化学方程式为:________________________________;
③相同温度下溶解度:Na4[Fe(CN)6]________K4[Fe(CN)6] (选填“>”、“<”或“=”)
(2)氰化钠(NaCN)是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。NaCN 的电子式为__________________________;实验室用NaCN固体配制NaCN溶液时,应先将其溶于氢氧化钠溶液中,再用蒸馏水稀释。NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是______________________________________。
(3)已知:氢氰酸是一种有苦杏仁气味的无色剧毒液体,易挥发,25℃时,Ka(HCN)=6.25×10-10。
①处理含CN-废水的方法是:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN-;第二步控制pH为7.5-8.5,用NaClO完全氧化OCN-生成N2和两种盐。
请写出第二步反应的离子方程式:_________________________________________。
②反应CN-+H2O![]() HCN+OH-在25℃时的平衡常数K=_____________(填数值)。
HCN+OH-在25℃时的平衡常数K=_____________(填数值)。
(4)K4Fe(CN)6与高锰酸钾溶液反应,其方程式为:
K4Fe(CN)6+KMnO4 +H2SO4=KHSO4+Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平), 若有1mol K4Fe(CN)6被高锰酸钾氧化时,则消耗KMnO4的物质的量为________mol。
【答案】 CaCO3 6NaCN+FeSO4+ CaCl2=CaSO4↓+Na4Fe(CN )6+2NaCl > ![]() CN-+H2O2+ H2O= HCO3-+ NH3↑ 2CNO-+3C1O-+2H2O=N2+3Cl-+2HCO3- 1.6×10-5 12.2
CN-+H2O2+ H2O= HCO3-+ NH3↑ 2CNO-+3C1O-+2H2O=N2+3Cl-+2HCO3- 1.6×10-5 12.2
【解析】试题分析:由流程可知,在反应器中发生反应6NaCN+FeSO4+ CaCl2=CaSO4↓+Na4Fe(CN )6+2NaCl,过滤后除去硫酸钙,向滤液中加入碳酸钠溶液,把溶液中的钙离子转化为碳酸钙除去,再向滤液中加入氯化钾溶液与Na4Fe(CN )6发生复分解反应生成溶解度更小的K4Fe(CN )6,过滤、洗涤、干燥得到K4Fe(CN )6。
(1)①在“除杂”步骤中弃渣的主要成分为CaCO3。②在“反应器“中发生的主要反应的化学方程式为6NaCN+FeSO4+ CaCl2=CaSO4↓+Na4Fe(CN )6+2NaCl;③相同温度下溶解度:Na4[Fe(CN)6] >K4[Fe(CN)6] 。
(2)NaCN 的电子式为![]() ; NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,则该酸式盐为碳酸氢钠,该气体为氨气,该反应的离子方程式是CN-+H2O2+ H2O= HCO3-+ NH3↑。
; NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,则该酸式盐为碳酸氢钠,该气体为氨气,该反应的离子方程式是CN-+H2O2+ H2O= HCO3-+ NH3↑。
(3)①处理含CN-废水的方法是:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN-;第二步控制pH为7.5-8.5,用NaClO完全氧化OCN-生成N2和两种盐,由组成元素可知,这两种盐为氯化钠和碳酸氢钠,第二步反应的离子方程式为2CNO-+3C1O-+2H2O=N2+3Cl-+2HCO3-。②反应CN-+H2O![]() HCN+OH-,在25℃时该反应的水解平衡常数K=
HCN+OH-,在25℃时该反应的水解平衡常数K=![]() 1.6×10-5。
1.6×10-5。
(4)K4Fe(CN)6与高锰酸钾溶液反应,其方程式为K4Fe(CN)6+KMnO4 +H2SO4=KHSO4+Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平),该反应中,K4Fe(CN)6中的Fe、C、N的化合价分别由+2、+2、-3升高到+3、+4、+5,KMnO4 中的Mn的化合价由+7下降到+2,根据化合价升降的总数相等,得到关系式10K4Fe(CN)6~122KMnO4, 所以,1mol K4Fe(CN)6被高锰酸钾氧化时,消耗KMnO4的物质的量为12.2mol。