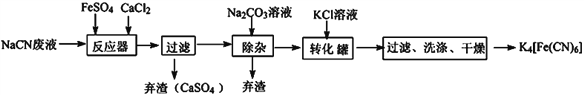
题目内容
【题目】下列有机物分子中,所有原子不可能在同一平面的是 ( )
A. 乙烯 B. 氯乙烯 C. 苯 D. 甲苯
【答案】D
【解析】
苯分子中12个原子处于同一平面上,C不选;由于甲烷为正四面体结构,甲苯可看作甲基(—CH3)取代了苯环上的一个氢原子,甲基的4个原子不可能都在同一平面上,D可选;乙烯分子中6个原子共平面,A不选;氯乙烯可以看作乙烯分子中一个氢原子被氯原子取代,所以氯乙烯分子中6个原子共平面,B不选;综上所述,本题选D。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】雾霾天气严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此改善能源结构、机动车限号等措施能有效减少PM2.5。SO2、NOx等污染。
请回答下列问题:
(1)将一定量的某PM2.5 样品用蒸馏水溶解制成待测试样(忽略OH-)。常温下测得该试样的组成及其浓度如下表:根据表中数据判断该试样的pH=________。
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | CI- |
浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)已知汽车汽缸中NO的生成反应为:N2(g)+ O2(g) ![]() 2NO(g) △H>0恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是______________。
2NO(g) △H>0恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是______________。
A.混合气体的密度不再变化 B.混合气体的压强不再变化
C.氧气的转化率不再变化 D.N2、O2、NO的物质的量之比为1: 1: 2
(3)为减少SO2 的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g) △H= -241.8kJ/mol
C(s)+1/2O2(g)==CO(g) △H=-110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式:__________________________。
②洗涤含SO2的烟气。下列可作为洗涤含SO2烟气的洗涤剂是________。
A.浓氨水 B.碳酸氢钠饱和溶液
C.FeCl2饱和溶液 D.酸性CaCl2饱和溶液
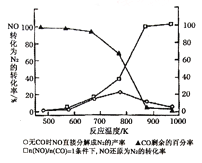
(4)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为____________,在n(NO)/n(CO)=1的条件下,为更好的除去NOx物质,应控制的最佳温度在______K左右。
(5)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO 和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:

①写出NO与活性炭反应的化学方程式____________________________。
②若T12,则该反应的△H_____________0(填”>”、“<”或“=”)。
③上述反应T1℃时达到化学平衡后再通入0.lmol NO气体,则达到新化学平衡时NO的转化率为___________________。
【题目】下表所示的体检报告的部分项目中,表示总胆固醇指标的物理量是( )
送检物:血液 检验目的:血常规 血型:O型 | 检验结果: 项目中文名称结果单位参考值 ALT谷丙转氨酶7U/L<40 ALB白蛋白43.9g/L35-55 TC总胆固醇4.27mmol/L3.6-5.18 |
A.溶解度B.质量分数C.密度D.物质的量浓度