题目内容
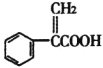
【题目】在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为-393.5 kJ/mol、-285.8 kJ/mol、-870.3 kJ/mol,则![]() CH3COOH(l)═C(s)+H2(g)+
CH3COOH(l)═C(s)+H2(g)+![]() O2(g)的反应热为( )
O2(g)的反应热为( )
A.-191 kJ/molB.+191 kJ/molC.+244.15 kJ/molD.+488.3 kJ/mol
【答案】C
【解析】
根据燃烧热写出热化学方程式,再利用盖斯定律来计算反应![]() CH3COOH(l)═C(s)+H2(g)+
CH3COOH(l)═C(s)+H2(g)+![]() O2(g)的反应热。
O2(g)的反应热。
25℃、101kPa下,H2(g)、C(s)和CH3COOH(l)的燃烧热分别是285.8kJmol-1、393.5kJmol-1和870.3kJmol-1,
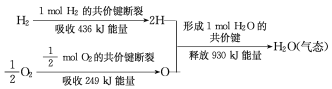
则H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJmol-1①,
O2(g)=H2O(l) △H=-285.8kJmol-1①,
C(s)+O2(g)=CO2(g) △H=-393.5kJmol-1②,
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H=-870.3kJmol-1③,
由盖斯定律可知,-![]() (①×2+②×2-③)可得反应
(①×2+②×2-③)可得反应![]() CH3COOH(l)═C(s)+H2(g)+
CH3COOH(l)═C(s)+H2(g)+![]() O2(g),其反应热为:-
O2(g),其反应热为:-![]() ×[2×(-285.8kJmol-1)+2×(-393.5kJmol-1)+870.3kJmol-1]=+244.15kJ/mol。
×[2×(-285.8kJmol-1)+2×(-393.5kJmol-1)+870.3kJmol-1]=+244.15kJ/mol。
答案选C。

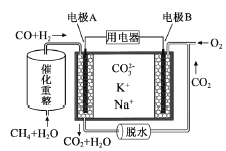
【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质)吸收含硫烟气(主要成分SO2)制备锰酸锂,生产流程:
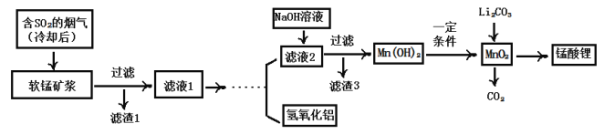
已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。
②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)含硫烟气在通入软锰矿浆前需要先冷却,冷却的原因是____________________。
(2)滤液1中所含金属阳离子有_____________(填离子符号)。
(3)在实际生产中,Li2CO3与MnO2按物质的量之比1∶4混合均匀加热制取LiMn2O4,反应过程:
①升温到515℃时,Li2CO3开始分解产生CO2和碱性氧化物A,写出A的名称________,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是_______________;
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B,固体B是______。
③升温到720℃时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出该阶段反应的化学方程式_________________。
(4)由“滤液1”得到“滤液2”同时回收Al(OH)3的实验方案如下:边搅拌边向滤液1中加入_____________,再加入NaOH溶液调节pH范围为____________,过滤得到滤液2和滤渣,向滤渣中加入NaOH溶液pH≥12,搅拌、过滤,再向所得滤液中通入过量的CO2过滤、洗涤、低温烘干得Al(OH)3。
(5)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是__________,宜选用_____(“阳”或“阴”)离子交换膜。
②b中,生成Li2CO3反应的化学方程式是__________________。