题目内容
【题目】乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰: 4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH。
(1)Mn3+基态价层电子排布图为________。
(2)Mn(NO3)2·6H2O中非金属元素第一电离能从大到小的顺序__________。从电子云重叠的方式看N中存在的化学键类型有__________。
(3)与NO2-互为等电子体的一种分子的化学式为________。
(4)1molCH3COOH中含有的σ键数目为___________。CH3COOH分子通过氢键形成环状二聚物,写出含氢键表示的环状二聚物的结构简式___________。
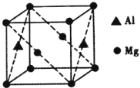
(5)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为_________。镁铝合金密度为ρg/cm3,则该晶胞的边长为__________nm(阿伏加德罗常数的值为N)。
【答案】![]() N >O> H σ键、
N >O> H σ键、![]() 键 O3或SO2 7NA
键 O3或SO2 7NA 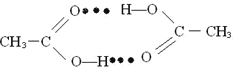 8
8 ![]() × l07
× l07
【解析】
(1)Mn是25号元素,Mn的价层电子排布式为[Ar]3d54s2,Mn3+的价层电子排布式为[Ar]3d4,其基态价层电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)Mn(NO3)2·6H2O中非金属元素有N、O、H,一般地,元素的非金属性越强,第一电离能越大,所以N、O的第一电离能比H大。N、O位于相同周期,N的2p轨道为半充满状态,N比O稳定,失去一个电子N比O难,所以N的第一电离能比O的第一电离能大,综上所述,三者的第一电离能从大到小为:N >O> H。硝酸根离子中的键是由N-Oσ键和一个4原子6电子的离域大π键构成的,故答案为:N >O> H;σ键、![]() 键;
键;
(3)价电子数和原子数相同的分子、离子或基团互为等电子体,可用S或者O替换N,同时去掉得到的一个电子,即O3或SO2,故答案为:O3或SO2;
(4)单键全是σ键,双键含一个σ键一个π键,所以1mol CH3COOH中含7mol的σ键,即σ键数为7NA。一个CH3COOH分子羧基中的O和另一个CH3COOH分子羧基中的H之间形成氢键,所以,2分子CH3COOH可通过氢键形成八元环的二聚物,结构简式为: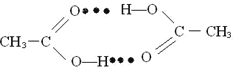 ,故答案为:7NA;
,故答案为:7NA;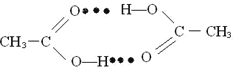 ;
;
(5)每个铝原子周围距离最近的镁原子有8个,距离为面对角线长的一半。由均摊法可知,1个晶胞中Al的个数=2×![]() =1,Mg的个数=8×
=1,Mg的个数=8×![]() +2×
+2×![]() =2,那么1个晶胞的质量=
=2,那么1个晶胞的质量=![]() g,设晶胞边长为a,1个晶胞的体积a3=
g,设晶胞边长为a,1个晶胞的体积a3=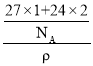 ,所以,边长a=
,所以,边长a=![]() cm=
cm=![]() × l07nm,故答案为:8;
× l07nm,故答案为:8;![]() × l07。
× l07。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案