题目内容
13.设NA为阿伏加德罗常数的值.下列说法中,正确的是( )| A. | 1mol Na被氧化完全转化生成Na2O2,失去电子数为2NA | |
| B. | 常温常压下,46g由NO2和N2O4组成的混合气体中含有原子的总数为3NA | |
| C. | 将lmL 1 mol•L-1FeCl3溶液逐滴加入沸水,制得红褐色Fe(OH)3胶体,所含胶粒的数目是1×10-3NA | |
| D. | 标准状况下,6.72L NO2与足量水充分反应转移的电子数目为0.3NA |
分析 A、反应后钠变为+1价;
B、NO2和N2O4的最简式均为NO2;
C、一个氢氧化铁胶粒是多个氢氧化铁分子的聚集体;
D、二氧化氮与水的反应中,3mol二氧化氮与水反应生成2mol硝酸和1mol一氧化氮,转移了2mol电子,据此计算出二氧化氮完全反应转移的电子数.
解答 解:A、反应后钠变为+1价,故1mol钠一定失去1mol电子即NA个,与其生成的产物是谁无关,故A错误;
B、NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量n=$\frac{46g}{46g/mol}$=1mol,故含有3mol原子即3NA个,故B正确;
C、一个氢氧化铁胶粒是多个氢氧化铁分子的聚集体,故将lmL 1 mol•L-1FeCl3溶液逐滴加入沸水,制得红褐色Fe(OH)3胶体,所含胶粒的数目小于1×10-3NA,
故C错误;
D、标况下,6.72L二氧化氮的物质的量为0.3mol,0.3mol二氧化氮与水完全反应生成0.2mol硝酸,转移了0.2mol电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4L H2含有的原子数为NA | |
| B. | 等质量的O2和O3中所含的氧原子数相等 | |
| C. | 同温同压下,相同体积的H2和O2,其质量比为1:16 | |
| D. | 28g CO与22.4L CO2所含的碳原子数相等 |
8.通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
则下列热化学方程式不正确的是( )
| 化学键 | A-A | B-B | A-B |
| 生成1mol化学键时放出的能量 | 436kJ•mol-1 | 243kJ•mol-1 | 431kJ•mol-1 |
| A. | $\frac{1}{2}$A2(g)+$\frac{1}{2}$B2(g)═AB(g)△H=-91.5 kJ•mol -1 | |
| B. | A2(g)+B2(g)═2AB(g)△H=-183 kJ•mol -1 | |
| C. | $\frac{1}{2}$A2(g)+$\frac{1}{2}$B2═AB(g)△H=+91.5 kJ•mol-1 | |
| D. | 2AB(g)═A2(g)+B2(g)△H=+183 kJ•mol-1 |
18.下列元素中,原子半径最小的是( )
| A. | Cl | B. | S | C. | P | D. | Si |

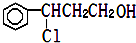 $\stackrel{②}{→}$X$→_{③△}^{NaOH乙醇溶液}$乙
$\stackrel{②}{→}$X$→_{③△}^{NaOH乙醇溶液}$乙 .
.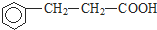 ).写出同时符合下列要求的丙的同分异构体结构简式
).写出同时符合下列要求的丙的同分异构体结构简式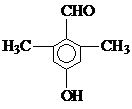 、
、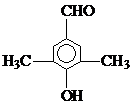 .
. 某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究,回答下列问题.
某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究,回答下列问题.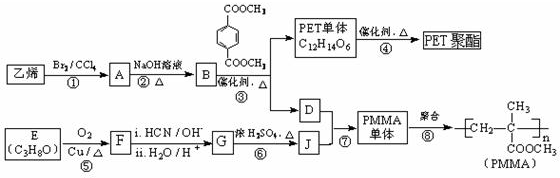
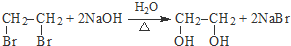 .
.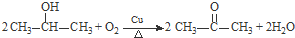 .
.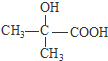 .
. 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH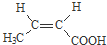 .
. .
.
 ;
;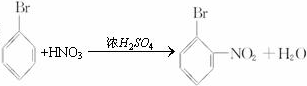 ;
; 、
、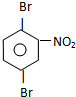 .
. 吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D.
吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D.