题目内容
【题目】人们对含硼(元素符号为“B”)物质结构的研究,极大地推动了结构化学的发展。回答下列问题:
(1)基态B原子价层电子的电子排布式为_____,核外电子占据最高能层的符号是____,占据该能层未成对电子的电子云轮廓图形状为____。
(2)1923年化学家Lewis提出了酸碱电子理论。酸碱电子理论认为:凡是可以接受电子对的物质称为酸,凡是可以给出电子对的物质称为碱。已知BF3与F-反应可生成BF4-,则该反应中BF3属于____(填“酸”或“碱”),原因是____。
(3)NaBH4是有机合成中常用的还原剂,NaBH4中的阴离子空间构型是_____,中心原子的杂化形式为____,NaBH4中存在____(填标号)
a.离子键 b.金属键 c.σ键 d.π键 e.氢键
(4)请比较第一电离能:IB____IBe(填“>”或“<”),原因是_______。
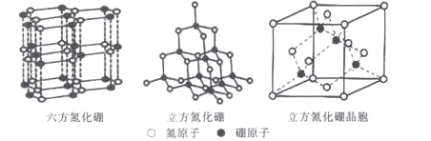
(5)六方氮化硼的结构与石墨类似,B—N共价单键的键长理论值为158pm,而六方氮化硼层内B、N原子间距的实测值为145 pm,造成这一差值的原因是____。高温高压下,六方氮化硼可转化为立方氮化硼,立方氮化硼的结构与金刚石类似,已知晶胞参数中边长为a=362 pm,则立方氮化硼的密度是____g/cm3。
【答案】2s22p1 L 哑铃形(或纺锤形) 酸 BF3中B采用sp2杂化,未参与杂化的2p空轨道接受F-的一对孤电子,形成配位键,因此BF3属于酸 正四面体 sp3 ac < Be原子的2s为全充满结构,较为稳定 层内B、N原子间形成了π键 ![]()
【解析】
(1)B为5号元素,据此书写B原子价层电子的电子排布式;
(2)B原子最外层含有3个电子,与3个F形成3个共用电子对,还存在1个空轨道,据此分析判断;
(3)根据价层电子对个数=σ键个数+孤电子对个数=σ键个数+![]() (a-xb)计算判断;
(a-xb)计算判断;
(4)Be原子的2s为全充满结构,较为稳定,据此分析判断;
(5)六方氮化硼的结构与石墨类似,层内B、N原子间形成了π键;根据晶胞结构图,利用均摊法计算一个晶胞中含有的白球数和黑球数,再确定一个晶胞的质量和体积,最后根据ρ=![]() 计算。
计算。
(1)B为5号元素,基态B原子价层电子的电子排布式为2s22p1,核外电子占据最高能层的符号为L,占据该能层未成对电子的为2p,电子云轮廓图为哑铃形(或纺锤形),故答案为:2s22p1;L;哑铃形(或纺锤形);
(2)根据酸碱电子理论:凡是可以接受电子对的物质称为酸,凡是可以给出电子对的物质称为碱。BF3中B采用sp2杂化,未参与杂化的2p空轨道接受F-的一对孤电子,形成配位键,因此BF3属于酸,故答案为:酸;BF3中B采用sp2杂化,未参与杂化的2p空轨道接受F-的一对孤电子,形成配位键,因此BF3属于酸;
(3)BH4-中B原子孤电子对数=![]() =0,价层电子对数=4+0=4,VSEPR模型为正四面体,没有孤电子对,空间构型为正四面体,B原子杂化方式为sp3,Na+、BH4-离子之间形成离子键,BH4-中B原子与H原子之间形成共价键和配位键,均属于σ键,故答案为:正四面体;sp3;ac;
=0,价层电子对数=4+0=4,VSEPR模型为正四面体,没有孤电子对,空间构型为正四面体,B原子杂化方式为sp3,Na+、BH4-离子之间形成离子键,BH4-中B原子与H原子之间形成共价键和配位键,均属于σ键,故答案为:正四面体;sp3;ac;
(4)Be原子的2s为全充满结构,较为稳定,使得第一电离能大于B第一电离能,故答案为:<;Be原子的2s为全充满结构,较为稳定;
(5)六方氮化硼的结构与石墨类似,层内B、N原子间形成了π键,使得B—N共价单键的键长变短;根据晶胞结构图,一个晶胞中含有的白球数=8×![]() +6×
+6×![]() =4,黑球数=4,因此立方氮化硼晶胞中应该含有4个N和4个B原子,一个晶胞的质量为
=4,黑球数=4,因此立方氮化硼晶胞中应该含有4个N和4个B原子,一个晶胞的质量为![]() ,一个立方氮化硼晶胞的体积是(362pm)3,根据ρ=
,一个立方氮化硼晶胞的体积是(362pm)3,根据ρ=![]() =
=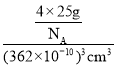 =
=![]() g/cm3,故答案为:层内B、N原子间形成了π键;
g/cm3,故答案为:层内B、N原子间形成了π键;![]() 。
。

 优加精卷系列答案
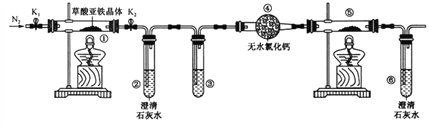
优加精卷系列答案【题目】控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
选项 | A | B |
装 置 图 |
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 |
选项 | C | D |
装 置 图 |
|
|
现象 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊 |
结论 | Ksp:AgCl>AgBr>AgI | 非金属性:C>Si |
A. A B. B C. C D. D