题目内容
【题目】海洋约占地球表面积的71%,具有十分巨大的开发潜力。工业上从海水中提取镁的流程如下:

下列说法中正确的是
A. 工业上使Mg2+沉淀,试剂①应选用NaOH
B. 将MgCl2溶液直接蒸干得到无水MgCl2
C. 电解MgCl2溶液在阴极得到金属Mg
D. 要使MgSO4完全转化为沉淀,加入试剂①的应过量
【答案】D
【解析】
A. 工业上使Mg2+沉淀,应选用廉价的石灰乳,可利用海边大量存在的贝壳煅烧成石灰制得,故A错误;
B. 氯化镁是强酸弱碱盐,加热时,氯化镁水解生成氢氧化镁和盐酸,升高温度促进盐酸挥发,所以小心蒸干氯化镁溶液最终得到氢氧化镁而不是氯化镁,故B错误;
C. 电解熔融MgCl2在阴极得到金属Mg,电解MgCl2溶液在阴极得到H2,故C错误;
D. 为了使镁离子完全转化,加入试剂①的量应过量,故D正确。
故答案选D。

【题目】唐山市打造“山水园林城市”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
SO2(g)+NH3·H2O(aq)![]() NH4HSO3(aq) ΔH1=a kJ·mol1;
NH4HSO3(aq) ΔH1=a kJ·mol1;
NH3·H2O(aq)+ NH4HSO3(aq)![]() (NH4)2SO3(ag)+H2O(l) ΔH 2=b kJ·mol1;
(NH4)2SO3(ag)+H2O(l) ΔH 2=b kJ·mol1;
2(NH4)2SO3(aq)+O2(g)![]() 2(NH4)2SO4(aq) ΔH 3=c kJ·mol1。
2(NH4)2SO4(aq) ΔH 3=c kJ·mol1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g) ![]() 2(NH4)2SO4(aq)+2H2O(l)的ΔH =____kJ·mol1。
2(NH4)2SO4(aq)+2H2O(l)的ΔH =____kJ·mol1。
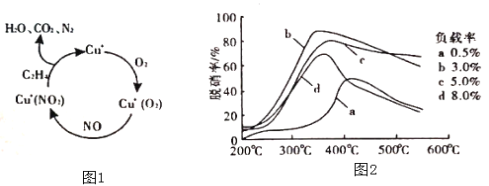
(2)以乙烯(C2H4)作为还原剂脱硝(NO),脱硝机理如图1,则总反应的化学方程式为_______;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2,为达到最佳脱硝效果,应采用的条件是______。
(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①T1温度时k正/k逆=__________ L/mol。
②若将容器的温度改变为T2时其k正=k逆,则T2__________T1(填“>”、“<”或“=")。
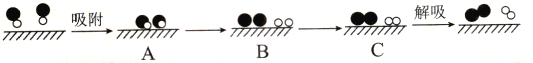
(4)已知:N2(g)+O2(g)![]() 2NO(g) △H=+181.5 kJ·mol-1,某科研小组尝试利用固体表面催化工艺进行NO的分解。若用
2NO(g) △H=+181.5 kJ·mol-1,某科研小组尝试利用固体表面催化工艺进行NO的分解。若用![]() 、
、![]() 、
、![]() 和
和![]() 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是___(填字母序号)。
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是___(填字母序号)。
(5)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度的10倍),装置示意图如下,固体电解质可传导O2-
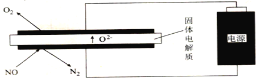
①阴极的电极反应式为______。
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)_________。