题目内容
【题目】实验室里制取乙烯时,常因温度过高而发生副反应,部分乙醇跟浓H2SO4反应生成SO2,CO2,水蒸气和炭黑。
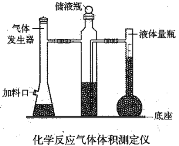
(1)用编号为①、②、③、④、⑤的实验装置设计一个实验,以验证上述反应混合气体中含CO2,SO2 和水蒸气.用装置的连接顺序(按产物气流从左到右的流向):______→______→______→______→______
①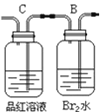 ②
②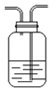 ③
③ ④
④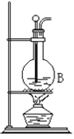 ⑤
⑤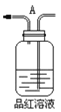
(2)实验的装置①中C瓶的现象是______;原因是_______
(3)B瓶中的现象是________;B瓶溶液作用为________
(4)若A瓶的现象是________,说明________
(5)装置③中加的固体药品是__________,以验证混合气体中有______装置②中盛的溶液是__________
【答案】④ ③ ① ⑤ ② 溶液褪色 二氧化硫的漂白性 溶液褪色 吸收多余的二氧化硫防止干扰实验 溶液不褪色 二氧化硫已经完全除尽 硫酸铜粉末 水蒸汽 澄清石灰水
【解析】
(1)多种产物需检验时,为了防止干扰,应考虑先后顺序;
(2)按装置①中C装的是品红溶液和气体成分和实验目的分析;
(3)按装置①中B装的是溴水和气体成分和实验目的分析;
(4)要证明二氧化碳存在,只能用澄清石灰水,前提是二氧化硫已除去,据此分析A的现象和结论;
(5)结合实验目的,③中固体药品用以验证混合气体中水蒸气,装置②中盛的溶液是用以检验二氧化碳,据此分析;
(1)多种产物需检验时,应考虑先后顺序,检验二氧化硫用品红溶液,检验二氧化碳用澄清的石灰水,检验水蒸气用无水硫酸铜,因溶液中有水,所以首先检验水蒸气;因为CO2是用澄清石灰水来检验的,而SO2也可以使澄清石灰水变浑,二氧化硫能使品红褪色,二氧化碳不能,所以,检验二氧化硫在检验二氧化碳之前,再通过澄清石灰水确认CO2存在;
答案为:④;③;①;⑤;②;
(2) 实验的装置①中C装的是品红溶液,当混合气体通过,品红褪色,因为产物中有二氧化硫,二氧化硫有漂白性;
答案为:溶液褪色;二氧化硫的漂白性 ;
(3) 装置②B中的溴水能和二氧化硫反应,用于吸收二氧化硫,假如二氧化硫不吸收,会干扰二氧化碳的检验;
答案为:溶液褪色;吸收多余的二氧化硫防止干扰实验;
(4)装置A用于检验混合气体中的二氧化硫已经除尽,装置②用于检验二氧化碳,若装置A品红溶液不褪色,装置②中澄清石灰水变浑浊,则证明混合气体中含有二氧化碳;
答案为:溶液不褪色;二氧化硫已经完全除尽;
(5) ③中固体药品用以验证混合气体中水蒸气,无水硫酸铜和水作用,白色变蓝色,可检验水蒸气;装置②中盛的澄清石灰水用以检验二氧化碳;
答案为:硫酸铜粉末;水蒸汽;澄清石灰水。

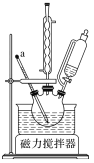
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制环己烯。
已知:![]()
密度( | 熔点℃ | 沸点℃ | 溶解性 | |
环己醇 | 0.096 | 25 | 161 | 能溶于水 |
环己烯 | 0.081 | -103 | 83 | 难溶于水 |
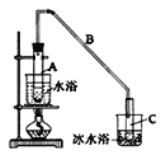
制备粗品:
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
(1)A中瓷片的作用是______,导管B除了导气外还具有的作用是______;
(2)试管C置于冰水浴中的目的是__________________________。
制备精品:
(3)环己烯粗品中含有环己醇和少量酸性杂质等。加入少量食盐水,振荡、静置、分层,环己烯在_______层(填“上”或“下”),分液后用_________(填入编号)洗涤;
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
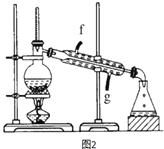
(4)再将环己烯按图2装置蒸馏,冷却水从_______(填f或g)口进入,蒸馏时要加入生石灰,目的是______________。收集产品时,温度应控制在_____左右。
(5)以下区分环己烯精品与粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
若用上述装置制备乙酸乙酯,回答下列问题。
(6)用分液漏斗提纯试管C中的乙酸乙酯,在操作时要注意振荡洗涤后,静置分液前必须放气,具体操作方法是__________(填编号)
a.将仪器正放在架子或铁圈上打开上部塞子
b.将仪器正放在架子或铁圈上打开活塞
c.用手心抵住仪器上部塞子倒置后打开活塞
d.将该仪器平放在实验台上打开活塞
(7)所制得的酯应从该分液漏斗的__________(填编号)
a.下部流出 b.上口倒出 c.都可以
(8)在提纯乙酸乙酯时,为什么要使用饱和碳酸钠溶液,而不用NaOH溶液洗涤?
______________________________________。