题目内容
【题目】解释下列过程的离子方程式不正确的是
A.K2Cr2O7 溶液中加入浓 NaOH 溶液后变黄:![]() +H2O
+H2O![]() 2
2![]() +2H+
+2H+
B.明矾溶于水产生Al(OH)3 胶体:Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
C.用碳酸钠溶液处理锅炉水垢中的硫酸钙:CaSO4+![]() ==CaCO3+
==CaCO3+![]()
D.向Ca(HCO3)2 溶液中滴加少量 NaOH 溶液生成白色沉淀:Ca2++2![]() +2OH-=CaCO3↓+
+2OH-=CaCO3↓+![]() +2H2O
+2H2O
【答案】D
【解析】
A.K2Cr2O7溶液中存在![]() +H2O
+H2O![]() 2
2![]() +2H+,加入浓 NaOH 溶液后,c(H+)浓度不断减少,平衡不断正向移动,c(
+2H+,加入浓 NaOH 溶液后,c(H+)浓度不断减少,平衡不断正向移动,c(![]() )不断增大,所以溶液不断变黄,A正确;
)不断增大,所以溶液不断变黄,A正确;
B.明矾[化学式为KAl(SO4)212H2O]溶于水后,Al3+发生水解产生Al(OH)3胶体,水解的离子方程式为:Al3++3H2O![]() Al(OH)3(胶体)+3H+,B正确;
Al(OH)3(胶体)+3H+,B正确;
C.硫酸钙在水中存在CaSO4(s)![]() Ca2++
Ca2++![]() ,用碳酸钠溶液处理锅炉水垢,Ca2+将与
,用碳酸钠溶液处理锅炉水垢,Ca2+将与![]() 反应生成CaCO3,反应的离子方程式为CaSO4+
反应生成CaCO3,反应的离子方程式为CaSO4+![]() ==CaCO3+
==CaCO3+![]() ,C正确;
,C正确;
D.向Ca(HCO3)2溶液中滴加少量 NaOH 溶液,依据“以少定多”的原则,OH-与![]() 完全反应生成
完全反应生成![]() ,
,![]() 全部生成CaCO3沉淀,离子方程式为Ca2++
全部生成CaCO3沉淀,离子方程式为Ca2++![]() +OH-=CaCO3↓+H2O,D不正确;
+OH-=CaCO3↓+H2O,D不正确;
故选D。

 同步练习强化拓展系列答案
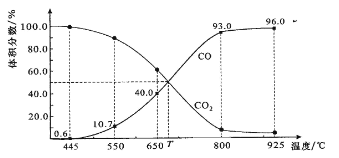
同步练习强化拓展系列答案【题目】对于反应:![]() ,当其他条件不变,只改变一个反应条件时,将生成SO3的速率的变化填入表格(填写“增大”“减小”或“不变”)。
,当其他条件不变,只改变一个反应条件时,将生成SO3的速率的变化填入表格(填写“增大”“减小”或“不变”)。
编号 | 改变的条件 | 生成SO3的速率 |
① | 升高温度 | _______ |
② | 降低温度 | _______ |
③ | 增大O2的浓度 | _______ |
④ | 使用V2O5作催化剂 | _______ |
【题目】某温度下,H2(g)+CO2(g)![]() H2O(g)+CO2(g)的平衡常数
H2O(g)+CO2(g)的平衡常数![]() 。该温度下在甲、乙、丙三个恒容密闭容器中,
。该温度下在甲、乙、丙三个恒容密闭容器中,
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol | 0.010 | 0.020 | 0.020 |
c(CO2)/mol | 0.010 | 0.010 | 0.020 |
投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
【题目】海水是一个巨大的化学资源宝库。
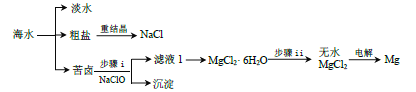
(1)海水中制得的氯化钠可用于生产烧碱及氯气,装置如图所示,下列说法正确的是____(填字母)。
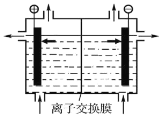
A.阴极反应式是:Na++e-=Na
B.可以用铁做阴极,石墨做阳极
C.烧碱和氯气都在阳极生成
D.离子交换膜是阴离子交换膜(只允许阴离子通过)
(2)苦卤的主要成分是 MgCl2,此外还含 Fe2+、Fe3+、Al3+等离子。已知:生成氢氧化物沉淀的 pH
氢氧化物 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Al(OH)3 | 3.7 | 4.7 |
Mg(OH)2 | 9.6 | 11.1 |
① 步骤 i 中加入 NaClO 的作用是_____,_____。
② 步骤 ii 需在 HCl 保护气中加热进行,HCl 保护气的作用是_____。
③ 若向苦卤中加入石灰乳,可以得到 Mg(OH)2沉淀,用化学平衡移动原理解释该反应过程_____。
(3)海水淡化前需对海水进行预处理。用如图所示 NaClO 的发生装置对海水进行消毒和灭藻处理。

① 装置中由NaCl 转化为NaClO 的离子方程式是_____,_____。
② 定量测定排出的海水中 Cl2 和 ClO-的含量。已知:2![]() +I2 =
+I2 =![]() +2I-。取 25.00 mL 排出的海水,加入过量 KI 溶液,然后用 a mol/LNa2S2O3 溶液滴定生成的 I2,达滴定终点时消耗Na2S2O3 溶液 b mL。该滴定操作选择的指示剂是_____,通过计算可知排出的 海水中 Cl2 和 ClO-的总物质的量浓度是_____mol/L。
+2I-。取 25.00 mL 排出的海水,加入过量 KI 溶液,然后用 a mol/LNa2S2O3 溶液滴定生成的 I2,达滴定终点时消耗Na2S2O3 溶液 b mL。该滴定操作选择的指示剂是_____,通过计算可知排出的 海水中 Cl2 和 ClO-的总物质的量浓度是_____mol/L。